
 ClO2作为消毒剂在消毒过程中对人体无毒无害,具有广泛的应用前景.某同学用下图所示的装置制备ClO2气体,反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)
ClO2作为消毒剂在消毒过程中对人体无毒无害,具有广泛的应用前景.某同学用下图所示的装置制备ClO2气体,反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)分析 (1)根据化学方程式:2KClO3+H2C2O4═2KHCO3+2ClO2↑可知,氯元素从+5价降为+4价,得电子,生成的ClO2为还原产物,1mol KClO3参加反应有1mol电子转移,碳元素从+3价升为+4价,失去电子,据此答题;
(2)反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2分析,控制水浴温度需要测量水浴的温度,水浴加热的优点之一就是便于控制温度,如果直接加热,则难以控制反应的温度;
(3)ClO2挥发能与氢氧化钠反应生成NaClO2、NaClO3;
(4)反应中的各物质化合价可知,氯元素从+5价降为+4价,碳元素从+3价升为+4价,根据化合价升降法可配平该反应方程式,根据反应中电子转移数目进行计算.
解答 解:(1)根据化学方程式:2KClO3+H2C2O4═2KHCO3+2ClO2↑可知,氯元素从+5价降为+4价,得电子,生成的ClO2为还原产物,1mol KClO3参加反应有1mol电子转移,碳元素从+3价升为+4价,失去电子,所以A、C正确,B、D错误,
故选AC;
(2)反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2分析,控制水浴温度需要测量水浴的温度,水浴加热的优点之一就是便于控制温度,如果直接加热,则难以控制反应的温度,所以不能将水浴换成直接加热,
故答案为:温度计;不可以,若直接加热温度难以控制;
(3)C中可能含有NaClO2、NaClO3的原因是ClO2挥发,进入C中,与氢氧化钠溶液反应,反应的方程式为2ClO2+2NaOH═NaClO2+NaClO3+H2O,
故答案为:ClO2挥发,进入C中,与氢氧化钠溶液反应,2ClO2+2NaOH═NaClO2+NaClO3+H2O;
(4)反应中的各物质化合价可知,氯元素从+5价降为+4价,碳元素从+3价升为+4价,根据化合价升降法可配平该反应方程式为2KClO3+H2C2O4+H2SO4═2ClO2↑+K2 SO4+2CO2↑+2H2O,根据反应可知每2mol氯酸钾参加反应转移2mol电子,所以0.5mol KClO3参加反应有0.5NA个电子转移,
故答案为:2、1、1、2、1、2、2;0.5NA.
点评 本题考查了物质性质的实验设计和实验分析判断,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,掌握实验基础和物质性质是解题关键,题目难度中等.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
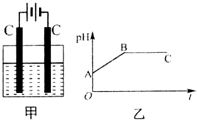 甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )
甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )| A. | 是该混合溶液中的SO42-导致了A点溶液的pH值小于B点 | |
| B. | BC段阴极产物和阳极产物的体积之比为2:1 | |
| C. | AB线段与BC线段在阴极上发生的反应是相同的即:Cu2++2e-→Cu | |
| D. | 在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )
85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )| A. | 青蒿素和双氢青蒿素互为同分异构体 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素的分子式为C15H22O5 | |
| D. | 青蒿素分子中含有过氧链和酯基、醚键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液和硫化钠溶液反应制备Al2S3 | |
| B. | 用镁粉和空气反应制备Mg3N2 | |
| C. | 用铝粉和MnO2制得锰 | |
| D. | 电解熔融氯化铝的方法制得单质铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应时增大水的用量 | |
| B. | Al在氧气中燃烧生成Al2O3,将铝片改成铝粉 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | Fe与硫酸反应制取H2时,选用浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com