
| A. | X、Y、W的最高价含氧酸酸性顺序:Y>W>X | |
| B. | 气态氢化物的稳定性:Z<W | |
| C. | X、W形成的化合物XW4属于离子化合物 | |
| D. | 原子半径:Z>W>X>Y |
分析 X、Y、Z、W为短周期主族元素,原子序数依次增大,Y的气态氢化物与最高价氧化物水化物可形成盐,则Y为N元素,X原子序数小于N元素,X的族序数是周期数的2倍,则X处于第二周期,X为C元素;Z的最外层电子数与其电子总数比为3:8,原子序数大于N元素,故Z处于第三周期,为S元素,W的原子序数最大,故W为Cl元素,据此解答.
解答 解:X、Y、Z、W为短周期主族元素,原子序数依次增大,Y的气态氢化物与最高价氧化物水化物可形成盐,则Y为N元素,X原子序数小于N元素,X的族序数是周期数的2倍,则X处于第二周期,X为C元素;Z的最外层电子数与其电子总数比为3:8,原子序数大于N元素,故Z处于第三周期,为S元素,W的原子序数最大,故W为Cl元素.
A.非金属性越强最高价含氧酸酸性越强,高氯酸是最强的无机含氧酸,故最高价含氧酸酸性顺序:高氯酸>硝酸>碳酸,故A错误;
B.非金属性Cl>S,则HCl比硫化氢稳定,故B正确;
C.X、W形成的化合物CCl4属于共价化合物,故C错误;
D.同周期随原子序数增大,原子半径减小,一般电子层越多原子半径越大,故原子半径Z(S)>W(Cl)>X(C)>Y(N),故D正确,
故选:BD.
点评 本题考查结构性质位置关系、元素周期律等,难度不大,注意基础知识的理解掌握.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:选择题
| A. | >0.1mol/L | B. | <0.1mol/L | C. | 0.1mol/L | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2 NaOH NaHCO3 | B. | AlCl3 NH3•H2O NaOH | ||
| C. | Ba(OH)2 CaCl2 Na2SO4 | D. | Na2CO3 MgCl2 H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | (3)用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 | 溶液PH=8 | (4)S2O32-+H2O?HS2O3-+OH- |
| 探究② | 向新制氯水(PH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | (5)Na2S2O3具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
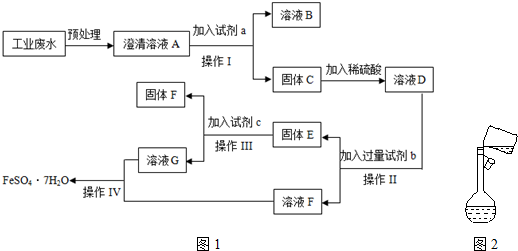
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、SO32-、Cl-、NO3- | B. | H+、NH4-、Al3+、SO42- | ||
| C. | Na+、S2-、OH-、SO42- | D. | Na+、Ca2+、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
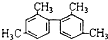 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有11个碳原子处于同一平面上 | |
| C. | 该有机物不能使酸性KMnO4溶液褪色 | |
| D. | 该烃属于苯的同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com