
下列反应不属于消去反应的是()
A. CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O
B. CH3CHBrCH3+NaOH CH3CH=CH2↑+NaBr+H2O
CH3CH=CH2↑+NaBr+H2O
C.  +2NaOH
+2NaOH
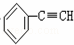 +2NaCl+2H2O
+2NaCl+2H2O
D. 2CH3OH CH3﹣O﹣CH3+H2O
CH3﹣O﹣CH3+H2O
考点: 消去反应与水解反应.
专题: 有机反应.
分析: 消去反应是指在一定条件下,有机物脱去小分子生成含有不饱和的有机物的反应;常见能发生消去反应的物质含有的官能团有﹣OH、﹣Cl、﹣Br等,取代反应:有机物分子里的原子或原子团被其他原子或原子团代替的反应;根据以上反应的概念进行判断.
解答: 解:A.CH3CH2OH CH2=CH2↑+H2O,乙醇中羟基脱去生成乙烯,该反应属于消去反应,故A错误;
CH2=CH2↑+H2O,乙醇中羟基脱去生成乙烯,该反应属于消去反应,故A错误;
B.CH3CHBrCH3+NaOH CH3CH=CH2↑+NaBr+H2O,2﹣溴丙烷在氢氧化钠的醇溶液中加热发生消去反应生成丙烯,该反应属于消去反应,故B错误;
CH3CH=CH2↑+NaBr+H2O,2﹣溴丙烷在氢氧化钠的醇溶液中加热发生消去反应生成丙烯,该反应属于消去反应,故B错误;
C. +2NaOH
+2NaOH
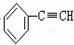 +2NaCl+2H2O,苯环侧链上的两个氯原子分别脱去生成了碳碳三键,该反应属于消去反应,故C错误;
+2NaCl+2H2O,苯环侧链上的两个氯原子分别脱去生成了碳碳三键,该反应属于消去反应,故C错误;
D.2CH3OH CH3﹣O﹣CH3+H2O,甲醇在浓硫酸作用下发生了分子间脱水生成甲醚,该反应属于取代反应,不属于消去反应,故D正确;
CH3﹣O﹣CH3+H2O,甲醇在浓硫酸作用下发生了分子间脱水生成甲醚,该反应属于取代反应,不属于消去反应,故D正确;
故选D.
点评: 本题考查了消去反应、取代反应的判断,题目难度不大,注意掌握常见有机反应的概念及判断方法,明确消去反应与加成反应、取代反应之间的区别.


科目:高中化学 来源: 题型:
84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶某品牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25% NaClO、1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为 mol·L-1。
(2)该同学取100 mL该品牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)≈ mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)该同学参阅该品牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是 。
A.选用480 mL的容量瓶
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,同体积的氨气和硫化氢气体(H2S)的质量比为 ;同质量的氨和硫化氢气体的体积比为 ,其中含有的氢的原子个数比为 ;若二者氢原子数相等,它们的体积比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃的分子式为C11H20,1mol该烃在催化剂作用下可以吸收2mol H2;用酸性KMnO4溶液氧化,得到丁酮(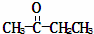 )、丙酮(
)、丙酮(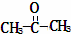 )和琥珀酸(
)和琥珀酸( )三者的混合物.该烃的结构简式为()
)三者的混合物.该烃的结构简式为()
A. 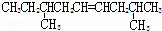 B.
B.  C.
C. 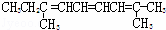 D.
D. 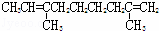
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下面的反应路线及所给信息填空:

(1)A的结构简式是 ,名称是 ;
(2)填写以下反应的反应类型:① ;② ;③ ;
(3)反应④的反应试剂及反应条件 ;
(4)反应②的化学方程式为 ;B水解的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
NaCl是一种化工原料,可以制备一系列物质(见图4)。下列说法正确的是

A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图4所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
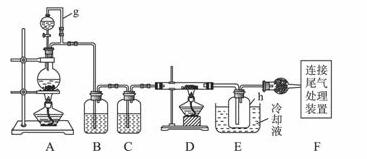
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl下标5 |
| 沸点/℃ | 57.7 | 12.8 | — | 315 | — |
| 熔点/℃ | -70.0 | -107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式____________。
(2)装置A中g管的作用是____________;装置C中的试剂是;装置E中的h瓶需要冷却的理由是____________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO-4+8H+====5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由__________________。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com