
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
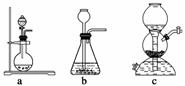
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是________(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36 L(标准状况)二氧化硫,至少需要称取亚硫酸钠________g(保留一位小数);如果已有40%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠________g (保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰石膏法和碱法是常用的烟气脱硫法。
石灰石膏法的吸收反应为SO2+Ca(OH)2―→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O―→2CaSO4·2H2O。其流程如下图:
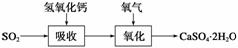
碱法的吸收反应为SO2+2NaOH―→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
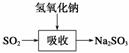
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰石膏法和碱法吸收二氧化硫的化学原理相同之处是
________________________________________________________________________。
和碱法相比,石灰-石膏法的优点是_______________________________________,
缺点是__________________________________________________________________。
(4)在石灰石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
答案 (1)ae
(2)18.9 33.1
(3)酸性氧化物与碱的反应 原料便宜,成本低 吸收慢,效率低
(4)
解析 用硫酸和亚硫酸钠反应制取二氧化硫,利用固液不加热制取气体装置,因此选ae。
设需Na2SO3的质量为m g
H2SO4+Na2SO3―→Na2SO4+SO2↑+H2O
126 g 22.4 L
m g 3.36 L m=18.9
设含40%的亚硫酸钠的样品质量为100 g,则生成硫酸钠的质量为45.1 g,则这时亚硫酸钠的质量分数为(100-40)/(100-40+45.1)=57.1%,则至少需称取该亚硫酸钠
18.9 g/57.1%=33.1 g。由于石灰的碱性比氢氧化钠弱,吸收SO2的速率慢、效率低,但吸收成本比氢氧化钠低的多。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
分子式为CnH2nO2的羧酸和某醇酯化生成分子式为Cn+2H2n+4O2的酯,参加反应的羧酸和醇的质量比为1∶1,则该羧酸是
A.乙酸 B.丙酸 C.甲酸 D.乙二酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
B.常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)/c(H+)=1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为:
c(B+)>c(OH-)>c(A-)>c(H+)
C.将等浓度的K2S和KHSO4两种溶液等体积,则混合溶液中离子浓度的大小关系为:c(K+)>c(SO42-)>c(HS-)>c(OH-)>c(H+)>c(S2-)
D.常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的3.5倍
(已知:Ksp(Cd(OH)2)=7.2×10-15,Ksp(Co(OH)2)=1.8×10-15)
查看答案和解析>>
科目:高中化学 来源: 题型:
将64 g铜箔加入到盛有含2 mol H2SO4的浓H2SO4试管中加热。
(1)铜箔能否完全溶解?请解释原因。
(2)在反应后的溶液中再加入少量硝酸钠晶体,铜箔表面又有气泡冒出,其原因为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸工业 尾气中二氧化硫的含量超过 0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
尾气中二氧化硫的含量超过 0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
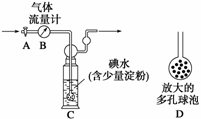
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是________________________________________________________________________
________________________________________________________________________。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种:__________________。
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量__________(填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如下面流程图所示:
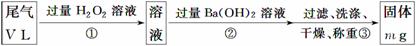
(4)写出步骤②中反应的化学方程式________________________________________。
(5)步骤③中洗涤沉淀的方法是____________________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为______________(用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液中,其余步骤与乙方案相同。
(7)你认为丙方案是否合理,说明理由:______________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象或事实可用同一原理解释的是 ( )
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去
C.漂白粉和水玻璃长期暴露在空气中变质
D.亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中几种常见物质的转化关系如下图(部分产物未列出)。A是一种金属单质,D是一种非金属固体单质。

请回答下列问题:
(1)A、C的化学式分别为A__________,C__________。
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是__________(填字母序号)。
A.C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.Fe+H2SO4===FeSO4+H2↑
C.Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.FeO+H2SO4===FeSO4+H2O
(3)写出反应E+H2O2―→F的化学方程式:__________________________________。
(4)若反应F+D―→E转移电子数为6.02×1023,则消耗D的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
寒冷的冬天,经常使用暖宝宝,暖宝宝中装的是铁粉、活性炭、无机盐等物质,打开包装以后,可以连续12个小时释放热量,以下分析错误的是
A.将化学能转化为热能
B.其发热原理与钢铁的吸氧腐蚀相同
C.铁作负极,电极反应为:Fe – 3e → Fe3+
D.活性炭作正极,电极反应为:2H2O + O2 + 4e → 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
随着人们生活质量提高,废电池必须进行集中处理的问题又被提到议事日程
上,其首要原因是 ( )
A.利用电池外壳的金属材料 B.回收其中石墨电极
C.防止电池中汞、镉和铅等重金属离子对水和土壤的污染
D.不使电池中泄漏的电解液腐蚀其他物品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com