
分析 23g液态酒精为0.5mol,利用已知的反应得出C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)的反应热,利用物质的量与反应放出的热量成正比来解答.
解答 解:①H2O(g)═H2O(l)△H1=Q1kJ•mol-1,
②C2H5OH(g)═C2H5OH(l)△H2=Q2kJ•mol-1,
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=Q3kJ•mol-1,
根据盖斯定律可知,①×3-②+③得C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(3Q1-Q2+Q3)kJ/mol,
即1mol液态酒精完全燃烧并恢复至室温,则放出的热量为(-3Q1+Q2-Q3)kJ,
则23g液态酒精完全燃烧并恢复至室温,则放出的热量为0.5×(-3Q1+Q2-Q3)kJ=(-1.5Q1+0.5Q2-0.5Q3)kJ,所以放出热量为1.5Q1-0.5Q2+0.5Q3,
故答案为:1.5Q1-0.5Q2+0.5Q3.
点评 本题考查学生利用盖斯定律计算反应热,明确已知反应和目标反应的关系是解答本题的关键,题目难度中等,注意Q为负值.


 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含碳原子总数为$\frac{m{N}_{A}}{14}$ | |
| B. | 所含碳氢键数目为$\frac{3m{N}_{A}}{14}$ | |
| C. | 所含共用电子对数目为($\frac{m}{14}$+1)NA | |
| D. | 完全燃烧时消耗的O2一定是 $\frac{33.6m}{14}$L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 一定条件下,1 mol N2与足量H2反应生成NH3,转移电子6NA | |
| C. | pH=13的氢氧化钠溶液中所含Na+为0.1NA | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
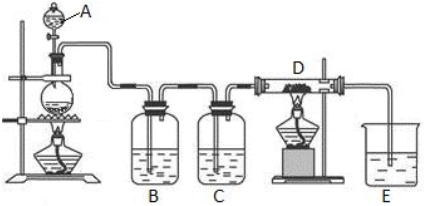
| A. | 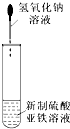 可以制备Fe(OH)2并可以较长时间观察到Fe(OH)2的颜色 | |
| B. | 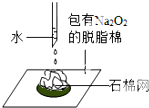 可以证明过氧化钠与水反应是放热反应 | |
| C. | 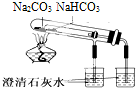 可以证明碳酸钠热稳定性比碳酸氢钠好 | |
| D. | 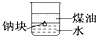 可以证明密度:ρ(煤油)<ρ(钠)<ρ(水) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3和Na2CO3均能和BaCl2反应 | |
| B. | NaHCO3和Na2CO3都能加热分解,产生使石灰水变浑浊的气体 | |
| C. | 质量相同的NaHCO3和Na2CO3分别与足量稀盐酸反应,NaHCO3放出气体多 | |
| D. | 可以用澄清石灰水来鉴别Na2CO3NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状态下,33.6 L氟化氢中含有1.5 NA个氟化氢分子 | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| C. | 1molNaCl晶体中含有NA个Na+ | |
| D. | 28g乙烯分子中含有极性共价键的数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl-、CO32- | B. | Mg2+、Al3+、OH-、SO42- | ||
| C. | H+、Ag+、Cl-、SO42- | D. | Fe2+、H+、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
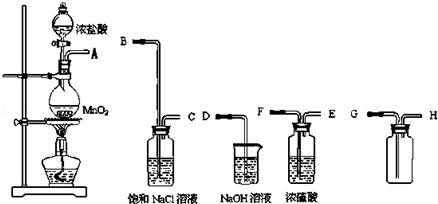
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com