
【题目】某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,其他电极均为Cu,则下列说法正确的是

A.电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ
B.电极Ⅰ发生还原反应
C.电极Ⅳ逐渐溶解
D.电极Ⅲ的电极反应:Cu-2e-===Cu2+
科目:高中化学 来源: 题型:
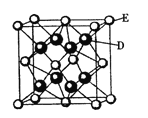
【题目】已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和。
请回答下列问题:
(1)分子式为BC2的空间构型为__ __;F2+的核外电子排布式为 。
(2)A分别与B、C形成的最简单化合物的稳定性B____C(填“大于”或“小于”);A、C两元素可组成原子个数比为1:1的化合物,C元素的杂化类型为 。
(3)A2C所形成的晶体类型为_ ___;F单质形成的晶体类型为 ,其采用的堆积方式为 。
(4)F元素氧化物的熔点比其硫化物的____(填“高”或 “低”),请解释其原因____。
(5)D跟E可形成离子化合物,其晶胞结构如右图。该离子化合物晶体的密度为pg.cm。3,则晶胞的体积是 。(用含p的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向一定体积的![]() 的
的![]() 溶液中逐滴加入
溶液中逐滴加入![]() 盐酸至过量,溶液中含碳元素的各微粒的物质的量浓度的百分含量随溶液pH的变化如图所示
盐酸至过量,溶液中含碳元素的各微粒的物质的量浓度的百分含量随溶液pH的变化如图所示![]() 因逸出未画出,滴加盐酸的过程中温度的变化忽略不计
因逸出未画出,滴加盐酸的过程中温度的变化忽略不计![]() 。下列说法正确的是
。下列说法正确的是![]()
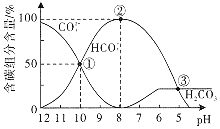
A.点![]() 时溶液中水的电离程度比纯水的大
时溶液中水的电离程度比纯水的大
B.点![]() 所示溶液中:
所示溶液中:![]()
C.当滴加盐酸到点![]() 时,才开始放出
时,才开始放出![]() 气体
气体
D.![]() 第一步水解反应的平衡常数:
第一步水解反应的平衡常数:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.由三种元素组成的化合物 A,按如下流程进行实验:
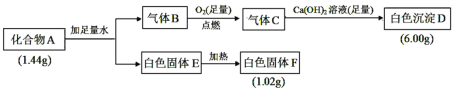
已知:①标准状况下,气体B的密度是氢气的8倍。②固体E既能溶于NaOH溶液又能溶于盐酸。
请回答:
(1)组成 A 的三种元素是__________,A 的化学式是________。
(2)固体 A 与足量稀盐酸反应的化学方程式是__________。
(3)气体 B 与足量 CuO 在加热条件下反应,请写出一个可能的化学方程式________________。
Ⅱ.某兴趣小组为探究 SO2 与 Fe(NO3)3 稀溶液反应的情况,实验装置如图,请回答:
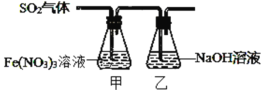
(1)实验过程中,甲中溶液由黄色变为浅绿色但立即又变为黄色。请写出甲中溶液由浅绿色变为黄色的离子方程式_____。
(2)请设计实验方案,检验反应后甲溶液中的金属阳离子______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用,其化合物也应用广泛。
(1)基态B原子的电子排布图为________________________,其第一电离能比Be___________(填“大”或“小”)。
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构简式为___________ (标出配位键),其中心原子的杂化方式为________,写出[BH4]-的一种阳离子等电子体_______。
(3)下图表示多硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数)。
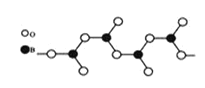
(4)硼酸晶体是片层结构,下图表示的是其中一层的结构。每一层内存在的作用力有_________。
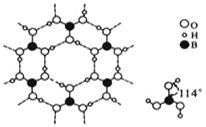
(5)三氯化硼的熔点比氯化镁的熔点低,原因是_______________________。
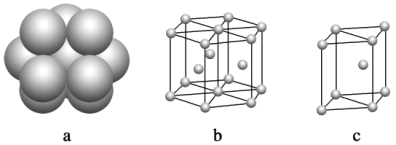
(6)镁单质晶体中原子的堆积模型如下图,它的堆积模型名称为_______;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伽德罗常数为NA,则镁的摩尔质量的计算式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校课外活动小组仅有一大一小两试管和氢氧化钠溶液。甲、乙两个同学找来铝制废牙膏皮,各自设计了一套装置如下图,制取并收集一试管氢气。
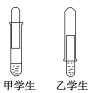
(1)哪个学生设计的装置比较合理?____(填“甲”或“乙”),另一设计装置不合理的原因____________
(2)用比较合理的装置制取氢气,要使氢气充满收集氢气的试管,应该采取的措施是____。
(3)还可以用哪些常见物品和试剂代替废牙膏皮和氢氧化钠溶液完成实验?_____________
(4)测定H2和空气混合气体的爆炸范围实验如下所述。取10支大试管,依次盛水90%(体积分数)、80%……再用排水集气法收集H2,而后分别把试管口移近酒精灯火焰,实验结果如下:
H2体积分数/% | 90 | 80 | 70 | 60~20 | 10 | 5 |
空气体积分数/% | 10 | 20 | 30 | 40~80 | 90 | 95 |
点燃现象 | 安静 燃烧 | 安静 燃烧 | 弱爆炸 | 强爆炸 | 弱爆炸 | 不燃烧 不爆炸 |
由上述实验结果评价:用向下排空气法收集H2,保持试管倒置移近火焰,如果只发出轻微的“噗声”,表示收集的H2已纯净的说法的真正涵义:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是( )
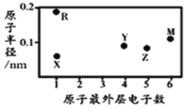
A.简单阳离子半径X最小
B.M的氢化物常温常压下为气体,分子间无氢键
C.最高价氧化物的水化物的酸性:Z<Y
D.X与Y可以形成平面形结构的分子,分子中存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCl3CHO可通过“CH3CH2OH+4Cl2→CCl3CHO+5HCl”进行制备。
⑴实验室常用KMnO4、MnO2或NaClO与浓盐酸反应制取Cl2。质量分数为36.5%,密度为1.18 g·cm-3盐酸,其物质的量浓度为______mol·L1。等物质的量的KMnO4、MnO2或NaClO与足量浓盐酸反应,理论上生成的Cl2的质量之比为______。
⑵可用如下方法测定所制CCl3CHO粗品的纯度(杂质不参与反应):称取该实验制备的产品5.00 g,配成100.00 mL溶液,取其中10.00 mL,加入一定量的NaOH后,加入30.00 mL 0.100 mol·L1的碘标准液,用0.100 mol·L1的Na2S2O3溶液滴定,重复上述3次操作,消耗Na2S2O3溶液平均体积为20.00 mL。实验中所发生反应如下:CCl3CHO+NaOH=CHCl3+HCOONa,HCOONa+I2=HI+NaI+CO2↑, I2+2Na2S2O3=2NaI+Na2S4O6,计算粗品中所含CCl3CHO的质量分数(写出计算过程)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制取乙烯并验证其性质的装置图。下列说法不正确的是( )
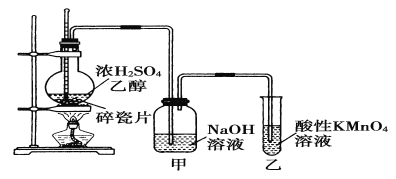
A.反应装置中浓硫酸和乙醇的体积比约为1:3
B.甲中NaOH溶液的作用是为了除去乙烯中的杂质气体
C.乙中溶液褪色,证明乙烯具有还原性
D.实验时,温度应该迅速升高到170℃并稳定在该温度最好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com