
| A�� | ��ʯī��һ��ۻ����� | B�� | ��ʯī�����Ա�ʯīǿ | ||
| C�� | ��ʯī��ˮ���������� | D�� | C8K��C24K��C36K����ͬ�������� |
���� �������������֪��ʯī�мذѵ��ӽ���ʯī�㣬˵����һ�����ӻ������ʯī���˵��ӣ������Ա�ʯīǿ�����������������Ӧ����������ʱ�����ջص��ӣ�������Ӧ�����Լ�ʯī��ˮ��������ˮ��Ӧ��ͬ����������ͬԪ����ɵIJ�ͬ���ʣ�
��� �⣺A����ʯī�У���ʧȥ���Ӹ�ʯī�㣬�γ������ӻ������A����
B����ʯī�У�ʯī����˵��ӣ�����������ʯīǿ����B��ȷ��
C����ʯī�������������Ӧ����������ʱ�����ջص��ӱ�ؽ����أ�������ˮ����ҷ�Ӧ����C����
D����ʯī�������C8K��C24K��C36K��C48K��C60K���ǻ��������ͬ�������壬��D����
��ѡB��
���� ���⿼����������Ϣ��������������ͬʱ����ʯī�ṹ��ͬ�����������ȣ���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �������ԣ���Na2CO3��NaHCO3��Һ���ܷ�Ӧ | |
| B�� | ��һ�������£�1 mol�������������3 mol NaOH��ȫ��Ӧ | |
| C�� | ��һ�������£������ʿ��Է���ȡ�����ӳɡ�ˮ�⡢��ȥ��Ӧ | |
| D�� | ���л������������̼ԭ�ӿ��ܹ�ƽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
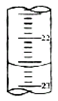 ����к��ڻ���������������ҪӦ�ã�
����к��ڻ���������������ҪӦ�ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
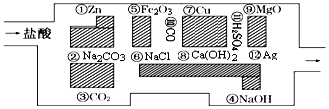
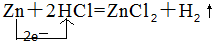 ��������������HCl����ԭ����Zn��
��������������HCl����ԭ����Zn���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | X����̬�⻯������ȶ��Ա�O��������ǿ | |
| B�� | Ԫ��Z��W�ļ����Ӿ�����ͬ�ĵ��Ӳ�ṹ | |
| C�� | Y��Z��W������������Ӧ��ˮ����֮�������Ӧ | |
| D�� | ��������Y��Z���ʷֱ�������ϡ���ᷴӦ��ǰ�߲����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ����� | ��Ʒ������/g | NaOH��Һ�����/mL | ���������/L |
| �� | 7.4 | 40.00 | 1.68 |
| �� | 14.8 | 40.00 | 3.36 |
| �� | 22.2 | 40.00 | 1.12 |
| �� | 37.0 | 40.00 | 0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ�䣨h�� ���ʵ�����mol�� | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��������Ԫ�ص����ʻ�ṹ��Ϣ���£�
��������Ԫ�ص����ʻ�ṹ��Ϣ���£�| Ԫ�ر�� | �����Ϣ |
| X | �ؿ��к������Ľ���Ԫ�أ�Ԫ�����Ϊ+3�ۣ� |
| Y | ԭ�������������ǵ��Ӳ�����2����������������X������������2���� |
| Z | ͬ��������Ԫ����ԭ�Ӱ뾶��С�������µ��ʳ�Һ̬�� |
| M | �ܴӺ�ˮ����ȡ�Ľ���Ԫ�أ����ʿ��ڵ����������̼��ȼ�գ� |
 ������Ԫ������������Ӧ��ˮ���������ǿ���ǣ�д����ʽ��Mg��OH��2��Ԫ����Ԫ�ط��ű�ʾ����ͬ������
������Ԫ������������Ӧ��ˮ���������ǿ���ǣ�д����ʽ��Mg��OH��2��Ԫ����Ԫ�ط��ű�ʾ����ͬ�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 25 | 200 | 300 | 400 | 500 |
| K | 5��108 | 1.0 | 0.86 | 0.507 | 0.152 |
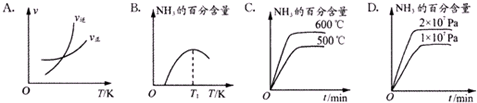
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com