
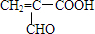 .
. .由E生成F的反应类型是酯化反应.
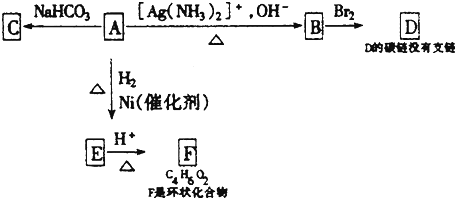
.由E生成F的反应类型是酯化反应. 分析 化合物A能与银氨溶液反应生成B,能与碳酸氢钠反应生成C,说明A含有-CHO、-COOH,B能与溴反应,说明A中含有碳碳不饱和键,1mol A与2mol H2反应生成1mol E,则A中含有1个-CHO、1个C=C双键,由F的分子式可知A中含有4个C原子,又由于B与溴反应生成的D中碳链没有支链,可推知A为OHC-CH=CH-COOH,顺推可得B为HOOC-CH=CH-COOH,D为HOOCCHBrCHBrCOOH,E为HOCH2CH2CH2COOH,F为 ,结合有机物的结构和性质解答该题.
,结合有机物的结构和性质解答该题.
解答 解:化合物A能与银氨溶液反应生成B,能与碳酸氢钠反应生成C,说明A含有-CHO、-COOH,B能与溴反应,说明A中含有碳碳不饱和键,1mol A与2mol H2反应生成1mol E,则A中含有1个-CHO、1个C=C双键,由F的分子式可知A中含有4个C原子,又由于B与溴反应生成的D中碳链没有支链,可推知A为OHC-CH=CH-COOH,顺推可得B为HOOC-CH=CH-COOH,D为HOOCCHBrCHBrCOOH,E为HOCH2CH2CH2COOH,F为 ,
,
(1)1molA中的双键和醛基均可以被氢气加成,共消耗2molH2,
反应方程式为HOOC-CH=CH-CHO+2H2$→_{△}^{催化剂}$CH2(OH)CH2CH2COOH,
故答案为:HOOC-CH=CH-CHO+2H2$→_{△}^{催化剂}$CH2(OH)CH2CH2COOH;
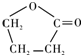
(2)A为HOOC-CH=CH-CHO,与A具有相同官能团的A的同分异构体的结构简式是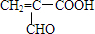 ,
,
故答案为: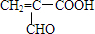 ;
;
(3)通过以上分析知,D结构简式为HOOCCHBrCHBrCOOH,故答案为:HOOCCHBrCHBrCOOH;
(4)E为CH2(OH)CH2CH2COOH,分子中含有-OH和-COOH,自身发生酯化反应可形成环酯F,F为 ,
,
故答案为: ;酯化反应.
;酯化反应.
点评 本题考查有机物推断,为高考常见题型,侧重考查学生分析推断能力,根据反应条件及某些物质结构进行推断,正确推断各物质结构简式是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 浓HNO3的氧化性比稀HNO3,故有时在实验室看到的浓硝酸呈黄色 | |
| B. | Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg | |
| C. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 | |
| D. | AlCl3易水解,故由AlCl3•6H2O制无水AlCl3应在HCl气流中加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 将Fe3O4固体溶于HI溶液中:Fe3O4+8H+=2Fe3++Fe2++4H2O | |
| C. | 将氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 向FeBr2溶液中通入少量的氯气:2Br-+Cl2=2Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入浓溴水生成白色沉淀 | |
| B. | 苯酚钠溶液中通入CO2后,溶液由澄清变浑浊 | |
| C. | 浑浊的苯酚加热后变澄清 | |
| D. | 苯酚的水溶液中加NaOH溶液,生成苯酚钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气和臭氧互为同素异形体 | |
| B. | CH3-CH2OH和 CH3-O-CH3互为同分异构体 | |
| C. | ${\;}_{2}^{3}$ He和${\;}_{2}^{4}$He互为同位素 | |
| D. | ${\;}_{2}^{4}$ He的最外层电子数为2,所以${\;}_{2}^{3}$He具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | CH3CH2OH | B. | CH3CHO | C. | HCOOH | D. | CH3CH2CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com