
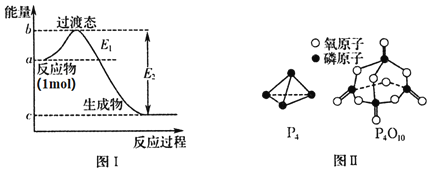
【题目】磷及其化合物在化工生产中有着广泛的应用,请对下列问题作答。
![]() 有多种单质,其中一种叫白磷,分子式为
有多种单质,其中一种叫白磷,分子式为![]() ,结构如图Ⅱ所示,
,结构如图Ⅱ所示,![]() 分子的活泼性比
分子的活泼性比![]() 分子______
分子______![]() 填强或弱
填强或弱![]() 。
。
![]() 白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设
白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设![]() 、
、![]() 、
、![]() 的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出
的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出![]() 的键能的表达式为______
的键能的表达式为______
![]() 已知含氧酸分子中只有羟基中的氢原子才能发生电离。
已知含氧酸分子中只有羟基中的氢原子才能发生电离。![]() 具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
![]() 可用于化学镀镍。配平并完成下列化学方程式:
可用于化学镀镍。配平并完成下列化学方程式:
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______
![]() 磷酸是一种三元中强酸,已知
磷酸是一种三元中强酸,已知![]() ,
,![]() ,
,![]() ,
,![]() 的水溶液显______性,解释原因______。
的水溶液显______性,解释原因______。
![]() 是重要的化工原料,某温度下,反应
是重要的化工原料,某温度下,反应![]() 的化学平衡常数
的化学平衡常数![]() ,在1L的密闭容器中加入
,在1L的密闭容器中加入![]() ,平衡后
,平衡后![]() 的浓度是______。
的浓度是______。
【答案】强 ![]()
![]() ;
; ![]() 1
1 ![]() 1 1
1 1 ![]() 酸
酸 ![]() 离子的水解常数为
离子的水解常数为![]() ,小于其电离常数
,小于其电离常数![]() ,所以显酸性
,所以显酸性 ![]()
【解析】
(1)P4分子中为单键结构,N2为三键结构,能量越高越活泼;
(2)白磷燃烧的方程式为P4+502=P4O10,根据化学键的断裂和形成的数目和焓变=反应物总键能-生成物总键能进行计算;
(3)已知含氧酸分子中只有羟基中的氢原子才能发生电离。H3PO2具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,为一元弱酸;
(4)根据氧化还原反应中化合价变化及质量守恒定律判断反应物和生成物,并配平反应方程式;
(5)NaH2PO4的水溶液中存在水解平衡,H2PO4+H2OH3PO4+OH,Kh=c(H3PO4)c(OH)c(H2PO4)=Kw÷Ka1,比较水解平衡常数和电离平衡常数判断电离程度和水解程度大小来确定溶液酸碱性;
(6)结合好三行计算列式计算平衡浓度,利用平衡常数表达式列式计算得到,逆反应平衡常数和正反应平衡常数互为倒数;
![]() 分子中为单键结构,磷原子半径大于氮原子,
分子中为单键结构,磷原子半径大于氮原子,![]() 为三键结构,所以
为三键结构,所以![]() 分子的活泼性强,故答案为:强;
分子的活泼性强,故答案为:强;
![]() 白磷燃烧的方程式为
白磷燃烧的方程式为![]() ,1mol白磷完全燃烧需拆开
,1mol白磷完全燃烧需拆开![]() 、
、![]() ,形成
,形成![]() 、
、![]() ,设
,设![]() 的键能为m,则根据反应热等于反应物的键能总和与生成物的键能总和的差可知,
的键能为m,则根据反应热等于反应物的键能总和与生成物的键能总和的差可知,![]() ,
,![]() ,故答案为:
,故答案为:![]() ;
;
![]() 已知含氧酸分子中只有羟基中的氢原子才能发生电离。
已知含氧酸分子中只有羟基中的氢原子才能发生电离。![]() 具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,为一元弱酸,电离方程式为:
具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,为一元弱酸,电离方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 由氧化还原反应中化合价升降相等进行配平:镍元素的化合价降低了2价,磷元素的化合价升高的2价,所以根据原子守恒结合电荷守恒可得配平的方程式为:
由氧化还原反应中化合价升降相等进行配平:镍元素的化合价降低了2价,磷元素的化合价升高的2价,所以根据原子守恒结合电荷守恒可得配平的方程式为:![]() ,故答案为:1、1、
,故答案为:1、1、![]() 、1、1、
、1、1、![]() ;
;
![]() 的水溶液中存在水解平衡,
的水溶液中存在水解平衡,![]() ,
, ,溶液中电离程度大,溶液显酸性,故答案为:酸;
,溶液中电离程度大,溶液显酸性,故答案为:酸;![]() 离子的水解常数为
离子的水解常数为![]() ,小于其电离常数
,小于其电离常数![]() ,所以显酸性;
,所以显酸性;
![]() 利用三行计算列式,某温度下,反应
利用三行计算列式,某温度下,反应![]() 的化学平衡常数
的化学平衡常数![]() ,则逆反应平衡常数
,则逆反应平衡常数![]() ,设生成氯气物质的量浓度为x:
,设生成氯气物质的量浓度为x:
![]()
起始量![]() 0 0
0 0
变化量![]() x x x
x x x
平衡量![]() span> x x
span> x x
![]() ,
,![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.软锰矿(MnO2)、菱锰矿(MnCO3)吸收烧结烟气中的SO2制取硫酸锰。pH值对SO2吸收率的影响如图所示。在吸收过程中,氧气溶解在矿浆中将 H2SO3氧化成硫酸。
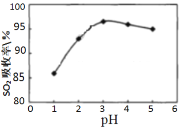
(1)SO2的吸收率在pH=_____效果最佳,MnO2所起的作用是_______,菱锰矿作为调控剂与硫酸反应, 确保pH的稳定,该反应的化学方程式为___________。
Ⅱ.沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)CO转化反应的平衡常数K(a)____K(c)(填“>”“<”或“=”,下同),在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率___α型,e点转化率出现突变的原因可能是______。
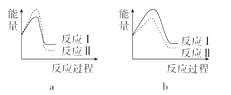
Ⅲ.N2H4是一种具有强还原性的物质。燃烧过程中释放的能量如下:(已知a>b)
① N2H4(g)+2O2(g) == NO2(g)+1/2N2(g)+2H2O(g) ΔH1=a kJ·mol-1
② N2H4(g)+2O2(g) == 2NO(g)+2H2O(g) ΔH2=b kJ·mol-1
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。

(4)试写出NO(g)分解生成N2(g)和NO2(g)的热化学方程式为_____________。
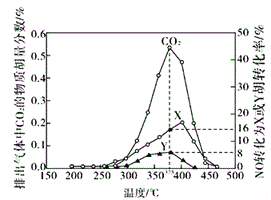
Ⅳ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如下图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525mol CO2,则Y的化学式为_____。实验过程中不采用NO2的模拟NOx原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如下装置处理含KMnO4的废液,使Mn元素转化为MnO2沉淀,从而消除重金属污染,下列说法错误的是

A. MnO4-处理完全后,实验结束时左侧可能会生成沉淀
B. 右侧产生的Fe2+沉淀MnO4-的离子方程式为:7H2O+3Fe2++MnO4-=3Fe(OH)3↓+MnO2↓+5H+
C. 当电路中转移6mole-时,可以产生87gMnO2沉淀
D. 为了增大右侧溶液的导电性可以加稀硫酸造成强酸性环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向lL0.lmol·L-1一元酸HR溶液中逐渐通人氨气[已知常温下Kb(NH3H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如右图所示。下列叙述正确的是( )

A. 0.1 mol·L-1HR溶液的pH约为3
B. HR为弱酸,常温时Ka (HR)=1×l0-7
C. 当通入0.1molNH3时,c(R-)>c(NH4+)
D. 当c(HR) =c(R-)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应的化学方程式中,属于水解反应的是( )
A.H2O+ H2O![]() H3O++OH-
H3O++OH-
B.CO2+H2O![]() H2CO3
H2CO3
C.HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
D.CO32-+ H2O![]() HCO3- +OH-
HCO3- +OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
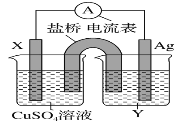
请回答下列问题:
(1)电极 X 的材料是__________填化学式);电解质溶液 Y 是______填化学式)。
(2)银电极发生______填“氧化”或“还原”)反应,其电极反应式为_________;X 电极反应式为_____。
II. 高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放 电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
请回答下列问题:
(1)已知放电时负极反应为 Zn-2e-+2OH- ===Zn(OH)2,则正极反应 为_____________。
(2)放电时,_____(填“正”或“负”)极附近溶液的 pH 升高。
(3)高铁电池充电时,电池的负极与电源的_____(填“正极”或“负极”),充 电时与电池负极相连的电极反应为__________。
III.近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和 水分子通过。其工作原理的示意图如下:
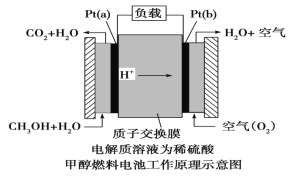
请回答下列问题: (1)该燃料电池的总反应为_________。
(2)Pt(a)电极是电池的_____(填“正”或“负”)极,电极反应式为:__________; Pt(b)电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列变化的化学用语正确的是
A.氨水显碱性:NH3·H2O ![]() NH4++OH-
NH4++OH-
B.醋酸溶液显酸性:CH3COOH = CH3COO-+ H+
C.NaHCO3溶液显碱性:HCO3-+H2O ![]() CO32- + OH-
CO32- + OH-
D.FeCl3溶液显酸性:Fe3++3H2O = Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在密闭容器内进行着某一反应,X气体![]() 、Y气体
、Y气体![]() 的物质的量随反应时间变化的曲线如图.下列叙述中正确的是
的物质的量随反应时间变化的曲线如图.下列叙述中正确的是![]()
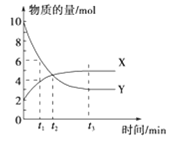
A.反应的化学方程式为![]()
B.![]() 时,Y的浓度是X浓度的
时,Y的浓度是X浓度的![]() 倍
倍
C.![]() 时,正、逆反应速率相等
时,正、逆反应速率相等
D.![]() 时,逆反应速率大于正反应速率
时,逆反应速率大于正反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com