
| A. | C1<C2<C3 | B. | C1=C2>C3 | C. | C1>C2>C3 | D. | 无法判断 |
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
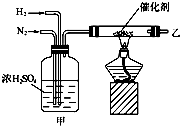 实验室合成氨的装置如图所示.
实验室合成氨的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
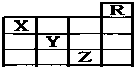 如图所示是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是:( )
如图所示是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是:( )| A. | ③ | B. | ①②③④ | C. | ①④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2s22p2 和2s22p4 | B. | 3s23p4 和2s22p4 | C. | 3s2和2s22p5 | D. | 3s1和3s23p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com