
检验SO2气体中是否含有CO2气体应用的方法是
A.通过石灰水 B.先通过酸性KMnO4溶液再通过石灰水
C.通过品红溶液 D.先通过小苏打溶液再通过石灰水
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
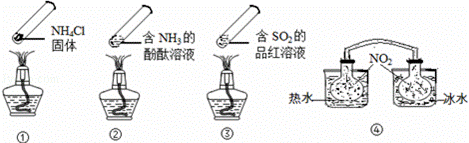
|
| A. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
|
| B. | 加热时,②、③溶液均变红,冷却后又都变为无色 |
|
| C. | ④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
|
| D. | 四个“封管实验”中所发生的化学反应都是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的做法错误的是
A.分液时,分液漏斗中的上层液体应由上口倒出
B.用加热的方法可区分碳酸钠和碳酸氢钠两种固体
C.用渗析的方法可除去Fe(OH)3胶体中混有的Cl-
D.加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂操作可行的是
A.通过浓硫酸除去HCl中的H2O B.通过灼热的CuO除去H2中的CO
C.通过灼热的镁粉除去N2中的O2 D.通过水除去CO中的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A. | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B. | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D. | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能 含有K+、
含有K+、
Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO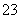 、SO
、SO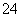 、Cl-中的若干种离子,该小组同学取100 mL水样进
、Cl-中的若干种离子,该小组同学取100 mL水样进
行实验:向样品中先滴加硝酸钡溶液,再滴加1 mol·L-1硝酸,实验过程中沉淀质量的变化如图所示:
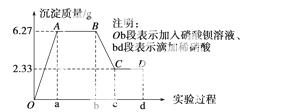
(1)水样中一定含有的阴离子是____________,其物 质的量浓度之比为________。
质的量浓度之比为________。
(2)写出BC段曲线所表示反应的离子方程式:______________________________。
(3)由B点到C点变化过程中消耗硝酸的 体积为_
体积为_ _______。
_______。
(4)试根据实验结果推测K+是否存在?____(填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是________________(若K+不存在,则不必回答)。
(5)设计简单实验验证原水样中可能存在的离子:
________________________________________ _______________________________
_______________________________
________________________________________________________________________
________________________________________________________________________。(写出实验步骤、现象和结论)
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是制取气体的一种装置,能用此装置制取气体并能“随开随用,随关随停”的是( )
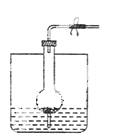
A.碱石灰与浓氨水制NH3 B.铝片与烧碱溶液制H2
C.电石与饱和食盐水制乙炔(C2H2) D.亚硫酸钠固体与75%的硫酸制SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用下图所示的装置制取乙酸乙酯。
 (1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液,其操作步骤为 ____
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液,其操作步骤为 ____ _______ ____________________________________,然后轻轻振荡试管使之混合均匀。
_______ ____________________________________,然后轻轻振荡试管使之混合均匀。
(2)装置中通蒸气的导管要插在饱和的Na2CO3溶液的液面上而不能插入溶液中,目的是防止溶液的倒吸。造成倒吸的原因是_______________________。
(3)浓硫酸的作用是:①__________________;②____________________。
(4)图中右边试管中试剂是_______________。
(5)分离得到乙酸乙酯的方法是__________,分离需要的玻璃仪器是____________________。
(6)若加的是C2H518OH写出制乙酸乙酯的方程式____________________________________。
(7)写出乙酸与碳酸氢钠反应方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
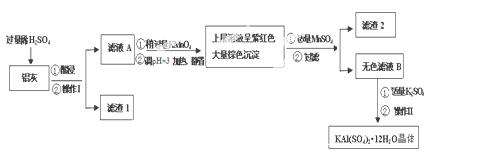
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 干燥。
(3)检验滤液A中是否存在Fe2+的方法是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾的目的是 ,发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的 。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为: 。滤渣2含有的物质是 。
(6)以Al和NiO(OH)为电极,KOH溶液为电解液可组成新型、高效电池,充放电过程中,发生Ni(OH)2与NiO(OH)之间的转化,写出放电时电池反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com