
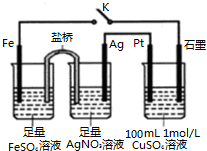
| A. | 盐桥中的电解质不可以用KCl | |
| B. | 闭合K,Pt电极上发生的反应为:4OH--4e-═O2↑+2H2O | |
| C. | 导线中流过0.5mol e-时,加入12.4g CuCO3,CuSO4溶液可恢复原组成 | |
| D. | 闭合K,整个电路中电流的流向为:Ag电极→Pt电极→石墨电极→Fe电极→Ag电极 |
分析 闭合K时,根据装置可以判断含有盐桥的为原电池装置,其中铁比银活泼为负极,银为正极,盛有硫酸铜溶液的装置为电解装置,与铁相连的石墨为阴极,阴极上铜离子得电子生成Cu,与银相连的Pt为阳极,阳极上氢氧根离子失电子生成氧气,以此解答该题.
解答 解:A.由于KCl能和AgNO3产生沉淀,因此盐桥中的电解质不能用KCl,故A正确;
B.与银相连的Pt为阳极,阳极上氢氧根离子失电子生成氧气,其电极方程式为:4OH--4e-═O2↑+2H2O,故B正确;
C.CuSO4溶液中n(Cu2+)=0.1mol,完全消耗时转移电子数为0.2mol,导线中流过0.5mol e-说明水也参与了电解,电解CuSO4的总反应2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,溶液中减少的是2Cu和O2(相当于2CuO),需要补充0.1molCuO,电解水的总反应2H2O=2H2↑+O2↑,转移电子数为0.3mol,因此消耗0.15mol的H2O,所以只加CuCO3,CuSO4溶液不可恢复原组成,故C错误;
D.闭合K,电流从正极流向阳极,从阴极流向负极,即电路中电流的流向为:Ag电极→Pt电极→石墨电极→Fe电极→Ag电极,故D正确
故选:C.
点评 本题考查原电池、电解池的工作原理,题目难度不大,注意电极的判断和电极方程式的书写,把握原电池、电解池的工作原理,学习中注意相关知识的把握.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的电离是指在电流作用下离解成钠离子和氯离子 | |
| B. | 溶于水后能电离出氢离子的化合物都是酸 | |
| C. | 硫酸钡难溶于水,所以硫酸钡属于弱电解质 | |
| D. | 醋酸溶液中存在H+、CH3COOH、CH3COO-等微粒,故醋酸是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |
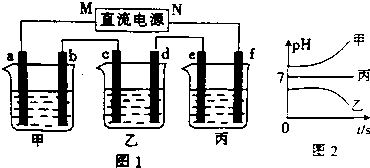
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈黄色的溶液中:K+、Na+、SO42-、S2O32- | |
| B. | 能与Al反应生成H2的溶液:Na+、Ba2+、NO3-、I- | |
| C. | 常温下水电离出的OH-为1×10-7mol/L的溶液中:K+、Na+、SO42-、AlO2- | |
| D. | 常温下pH=7的溶液中:NH4+、K+、CH3COO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 用浓硫酸配制一定物质的量浓度的硫酸溶液时,溶解后的溶液未冷却至室温就转移入容量瓶,会造成所配溶液浓度偏高 | |
| C. | 溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,变浑浊,原溶液一定含有CO32- | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com