
 ;分子N中含有2个手性碳原子.
;分子N中含有2个手性碳原子. 分析 (1)①根据盖斯定律进行计算;
②二氧化硫属于酸性氧化物,能和碱液反应,亚硫酸酸性大于碳酸,所以能和可溶性碳酸盐反应;
(2)3BrF3+5H2O═HBrO3+Br2+9HF+O2中,Br元素化合价由+3价变为+5价、-1价,部分O元素化合价由-2价变为0价,该反应中有2mol水作还原剂,根据转移电子守恒计算被水还原的BrF3的物质的量;
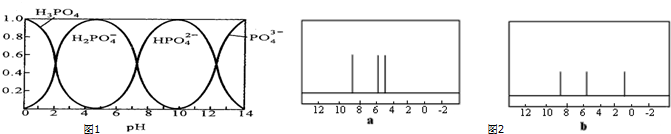
(3)①溶液中H2PO4-浓度减小、H3PO4浓度增大,据此书写离子方程式;
②根据溶液中存在的离子与溶液pH的关系判断;
(4)C5H6的核磁共振氢谱有3个吸收峰,说明含有三类H原子,该分子不饱和度=$\frac{5×2+2-6}{2}$=3,说明含有两个碳碳双键,且符合条件的该物质结构简式为 ,C5H6与Br2 1:1加成后产物有M、N两种,M的核磁共振氢谱有3种H原子,所以该物质发生1,3加成,N是该物质发生1,2加成得到的产物.
,C5H6与Br2 1:1加成后产物有M、N两种,M的核磁共振氢谱有3种H原子,所以该物质发生1,3加成,N是该物质发生1,2加成得到的产物.
解答 解:(1)①2H2(g)+O2(g)═2H2O(g)△H1=-d kJ•mol-1①
2C(s)+O2(g)═2CO(g)△H2=-e kJ•mol-1②
C(s)+O2(g)═CO2(g)△H3=-f kJ•mol-1③
将方程式$\frac{①+②}{2}$得CO(g)+H2O(g)=CO (g)+H2(g)△H=(0.5d+0.5e-f)kJ•mol-1,
故答案为:CO(g)+H2O(g)=CO (g)+H2(g)△H=(0.5d+0.5e-f)kJ•mol-1;
②二氧化硫属于酸性氧化物,能和碱液反应,亚硫酸酸性大于碳酸,所以能和可溶性碳酸盐反应,加入稀硫酸后能得到二氧化硫且得到化肥,故选ce;
(2)3BrF3+5H2O═HBrO3+Br2+9HF+O2中,Br元素化合价由+3价变为+5价、-1价,部分O元素化合价由-2价变为0价,该反应中有5mol水作还原剂,水失去电子的物质的量=5mol×(2-0)=10mol,根据转移电子守恒得被水还原的BrF3的物质的量=$\frac{10mol}{3-0}$=$\frac{10}{3}$mol,故答案为:$\frac{10}{3}$;
(3)①根据图象知,pH从5转化为0时,溶液中H2PO4-浓度减小、H3PO4浓度增大,离子反应方程式为H2PO4-+H+=H3PO4,故答案为:H2PO4-+H+=H3PO4;
②根据图知,H2PO4-存在的pH范围为0~10、PO43-存在的pH>10,所以二者不能共存,故答案为:不能;
(4)C5H6的核磁共振氢谱有3个吸收峰,说明含有三类H原子,该分子不饱和度=$\frac{5×2+2-6}{2}$=3,说明含有两个碳碳双键,且符合条件的该物质结构简式为 ,C5H6与Br2 1:1加成后产物有M、N两种,M的核磁共振氢谱有3种H原子,所以该物质发生1,3加成,N是该物质发生1,2加成得到的产物,连接溴原子的C原子为手性碳原子,所以有两个,故答案为:
,C5H6与Br2 1:1加成后产物有M、N两种,M的核磁共振氢谱有3种H原子,所以该物质发生1,3加成,N是该物质发生1,2加成得到的产物,连接溴原子的C原子为手性碳原子,所以有两个,故答案为: ;2.
;2.
点评 本题考查较综合,涉及存在离子与pH的关系、氧化还原反应的计算、盖斯定律等知识点,同时考查学生分析图象、解答问题能力,难点是(2)题计算,注意水和BrF3中元素化合价变化,为易错点.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:选择题
| A. | “水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中的二氧化碳接触,生成 了乳白色的凝胶状沉淀(用H2SiO3表示)和碳酸钠的缘故 | |
| B. | 水的物理性质十分特殊.水的比热容较大,水结成冰后密度变小,水的熔沸点较高等特殊 性质是由于水分子间存在一种被称为氢键的特殊的分子间作用力 | |
| C. | 铅蓄电池是最常见的二次电池,由于它的性能优良、价格低廉、安全可靠,可多次充放电,所以使用广泛,但铅蓄电池也存在比能量低,废弃电池污染环境等缺点 | |
| D. | 硅晶体是一种重要的半导体材料,在常温下,单质硅易与氧气反应,所以自然界中不存在 游离态的硅.石墨烯作为目前发现的最薄、强度最大、导电导热性能最强的一种新型纳米材 料,最有潜力的应用是成为硅的替代品,用来生产未来的超级计算机 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物 | |
| C. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| D. | 用合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
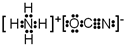 或
或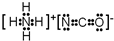 .
.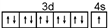 .A、B元素形成的最简单的化合物不能与E2+形成配合物的原因是CH4不能提供孤对电子.
.A、B元素形成的最简单的化合物不能与E2+形成配合物的原因是CH4不能提供孤对电子.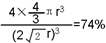 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物XZ2中,各原子均满足8电子的稳定结构 | |
| B. | 元素X与氢元素能形成原子数目之比为1:1的化合物 | |
| C. | Y的单质与稀硫酸、浓硫酸均可发生氧化还原反应 | |
| D. | Z的单质在加热条件下会与Fe反应生成Fe3Z4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;ZX2的化学式是SiO2.
;ZX2的化学式是SiO2.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 温度/℃ | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该方应的正反应放热 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com