
| A. | 电解饱和食盐水可制得金属钠 | |
| B. | 工业上用焦炭在高温下还原二氧化硅可制得粗硅 | |
| C. | 高炉炼铁的主要反应是高温下焦炭和氧化铁直接作用炼出铁 | |
| D. | 不通过化学变化就可以从海水中提取溴单质 |
分析 A、电解饱和食盐水得到氢氧化钠、氯气和氢气;
B、焦炭高温还原二氧化硅制备粗硅;
C、一氧化碳还原氧化铁可以获得金属铁;
D、溴元素在海水中以Br-中存在.
解答 解:A.钠离子是水溶液中不放电,电解饱和食盐水得到氢氧化钠、氯气和氢气,应用电解熔融的氯化钠的方法冶炼钠,故A错误;
B、焦炭高温还原二氧化硅制备粗硅,工业上,用焦炭在高温下还原二氧化硅制得粗硅,故B正确;
C、工业上高炉炼铁的原理是:一氧化碳还原氧化铁可以获得金属铁,即Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,故C错误;
D、溴元素在海水中以Br-中存在,故要提取溴单质,需溴元素发生氧化反应,故D错误.
故选B.
点评 本题主要考查基本知识和基本反应原理,需要正确记忆并深化理解,注意基础知识的积累,题目较简单.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:选择题
| A. | 4 v(NH3)=5 v(O2) | B. | 5v(O2)=6 v(H2O) | C. | 2 v(NH3)=3 v(H2O) | D. | 4v(O2)=5 v(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验序号 | 盐酸体积(mL) |
| 第一组 | 19.90 |
| 第二组 | 24.70 |
| 第三组 | 20.10 |
| 第四组 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
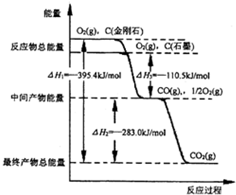 CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.
CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自来水厂可用明矾作净水剂 | |
| B. | 二氧化硅既能与氢氟酸反应又能与氢氧化钠溶液反应,所以二氧化硅是两性氧化物 | |
| C. | 丁达尔效应是区分胶体与溶液的一种常用方法 | |
| D. | MgO、Al2O3熔点高,可用于制作耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
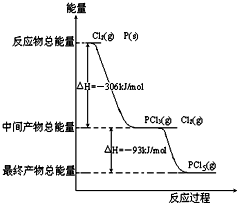 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com