
| A. | 钢铁吸氧腐蚀过程中正极反应为2H++2e-═H2↑ | |
| B. | 惰性电极电解熔融NaCl时阴极、阳极产生气体体积比为1:1 | |
| C. | H2在反应Li2NH+H2═LiNH2+LiH中既是氧化剂又是还原剂 | |
| D. | 用铁做电极电解CuCl2溶液的离子方程式为Cu2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑ |
分析 A.钢铁吸氧腐蚀,正极上氧气得到电子;
B.惰性电极电解熔融NaCl,生成Na、氯气;
C.只有H元素的化合价变化;
D.用铁做电极电解CuCl2溶液,阳极Fe失去电子,阴极铜离子得到电子.
解答 解:A.钢铁吸氧腐蚀,正极上氧气得到电子,正极反应为O2+2H2O+4e-═4OH-,故A错误;
B.惰性电极电解熔融NaCl,生成Na、氯气,阴极上不生成气体,故B错误;
C.只有H元素的化合价变化,则H2在反应Li2NH+H2═LiNH2+LiH中既是氧化剂又是还原剂,故C正确;
D.用铁做电极电解CuCl2溶液,阳极Fe失去电子,阴极铜离子得到电子,则铁做电极电解CuCl2溶液的离子方程式为Cu2++Fe-$\frac{\underline{\;电解\;}}{\;}$Cu+Fe2+,故D错误;
故选C.
点评 本题考查原电池及电解池,为高频考点,把握工作原理及电极反应为解答的关键,侧重分析与应用能力的考查,注意电化学知识的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
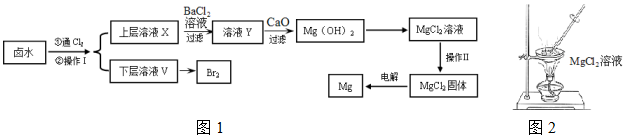
| 开始沉淀时 | 沉淀完全时 | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
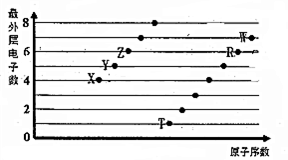 部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题:
部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题: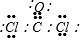 ;已知1mol XZW2与4mol NaOH
;已知1mol XZW2与4mol NaOH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: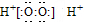 | |
| B. | 氮原子最外层电子轨道表达式: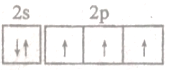 | |
| C. | Cl中子数为18的氯原子结构示意图: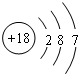 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3?Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
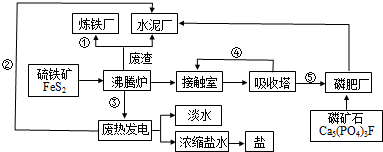
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑤ | C. | ③④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ | |
| B. | 稀H2SO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4+H2O | |
| C. | 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═2C6H5OH+SO32- | |
| D. | 醋酸钠的水解反应:CH3COO-+H3O+═CH3COOH+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
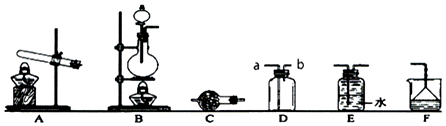
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com