
| A. | 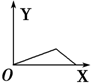 | B. | 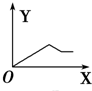 | C. | 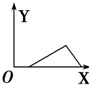 | D. |  |
分析 AlCl3和MgCl2的混合溶液中,相同条件下Al3+比Mg2+更易与OH-反应生成沉淀,故向混合溶液逐滴加入NaOH溶液,铝离子首先转化为氢氧化铝沉淀,当铝离子完全沉淀,镁离子再转化为氢氧化镁沉淀,当镁离子沉淀完全,再加入氢氧化钠,氢氧化铝溶解,沉淀的质量减少,而氢氧化镁不溶于碱,由此分析.
解答 解:AlCl3和MgCl2的混合溶液中,相同条件下Al3+比Mg2+更易与OH-反应生成沉淀,故向混合溶液逐滴加入NaOH溶液,铝离子首先转化为氢氧化铝沉淀,当铝离子完全沉淀,镁离子再转化为氢氧化镁沉淀,当镁离子沉淀完全,再加入氢氧化钠,氢氧化铝溶解,沉淀的质量减少,而氢氧化镁不溶于碱,故沉淀减少到一定值不再变化,所以图象为: ,故选B.
,故选B.
点评 本题考查铝及化合物的性质、化学反应图象等,根据反应过程判断沉淀与氢氧化钠体积关系,注意纵坐标表示沉淀的物质的量,不是氢氧化铝.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | CO(NH2)2 | B. | (NH4)2CO3 | C. | NH4NO3 | D. | CH3COONH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
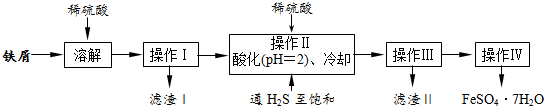
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③ | C. | ①③⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存在水中 | B. | 密封,保存在广口瓶中 | ||
| C. | 用铝箔包裹,密封在广口瓶中 | D. | 密封,保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com