
����Ŀ��ij��Һֻ�����������ӣ�![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �����
�е�����![]() ����ˮ�ĵ��뼰�ε�ˮ��
����ˮ�ĵ��뼰�ε�ˮ��![]() ���Ҹ����ӵ����ʵ���Ũ����ȣ��ֽ�������ʵ�飺
���Ҹ����ӵ����ʵ���Ũ����ȣ��ֽ�������ʵ�飺
![]() ȡ��������Һ��NaOH��Һ���ȣ������̼�����ζ�����壬δ�۲쵽������������
ȡ��������Һ��NaOH��Һ���ȣ������̼�����ζ�����壬δ�۲쵽������������
![]() ȡ��������Һ�����������ᣬ�ɹ۲쵽����ɫ���壬δ�۲쵽�������ɡ�
ȡ��������Һ�����������ᣬ�ɹ۲쵽����ɫ���壬δ�۲쵽�������ɡ�
��������ʵ�飬����˵����ȷ����
A.����ʵ��![]() ֻ��ȷ��ԭ��Һ��һ����
ֻ��ȷ��ԭ��Һ��һ����![]() ��û��
��û��![]()
B.ȡʵ��![]() �����Һ�μӵ��ۣ���Һ����ɫ
�����Һ�μӵ��ۣ���Һ����ɫ
C.ԭ��Һ�п��ܺ���![]() ��
��![]() ��
��![]() ��
��![]() ��������
��������
D.ȡ����ԭ��Һ�����Ը��������Һ�����������ӱ�����
���𰸡�B
��������
![]() ȡ��������Һ��NaOH��Һ���ȣ������̼�����ζ������
ȡ��������Һ��NaOH��Һ���ȣ������̼�����ζ������![]() ������Һ�к�
������Һ�к�![]() ������
������![]() �����������ӣ��ܺ�
�����������ӣ��ܺ�![]() ����˫ˮ�⣬����Һ����
����˫ˮ�⣬����Һ����![]() ��δ�۲쵽��������������Һ����
��δ�۲쵽��������������Һ����![]() ��
��![]() ��ȡ��������Һ�����������ᣬ�ɹ۲쵽����ɫ���壬˵����Һ���л�ԭ�����ӣ���
��ȡ��������Һ�����������ᣬ�ɹ۲쵽����ɫ���壬˵����Һ���л�ԭ�����ӣ���![]() ��
��![]() ���л�������һ�֣�����Һ��һ����
���л�������һ�֣�����Һ��һ����![]() ��
��![]() ��һ����
��һ����![]() ��
��![]() ��
��![]() ���л�������һ�֣�������
���л�������һ�֣�������![]() ��
��![]() ����������Ҫ����4�֣��Ҹ����ӵ����ʵ���Ũ����ȣ�������ҺҪ�������غ��֪����Һ�в��ܴ���
����������Ҫ����4�֣��Ҹ����ӵ����ʵ���Ũ����ȣ�������ҺҪ�������غ��֪����Һ�в��ܴ���![]() ������Һ����
������Һ����![]() ʱ����һ������
ʱ����һ������![]() ��
��![]() �����ܺ�
�����ܺ�![]() ��
��![]() ����ʱ��Һ�����������4�֣�����������Ҫ������Һ��һ����
����ʱ��Һ�����������4�֣�����������Ҫ������Һ��һ����![]() ������Ҫ����Һ������������Ũ����ȣ�����Һ��һ����
������Ҫ����Һ������������Ũ����ȣ�����Һ��һ����![]() ��
��![]() ��
��![]() ��
��![]() ��
��
A.��ʵ��![]() ������ȷ��ԭ��Һ��һ����
������ȷ��ԭ��Һ��һ����![]() ��û��
��û��![]() ��
��![]() ����A����
����A����
B.������Һ�к�![]() ���ʼ���������������ܽ�������Ϊ
���ʼ���������������ܽ�������Ϊ![]() ���ʼ�����ۺ��������B��ȷ��
���ʼ�����ۺ��������B��ȷ��
C.�������������֪��Һ��һ����![]() ��
��![]() ��
��![]() ��
��![]() ��һ��û�У�
��һ��û�У�![]() ��
��![]() ��
��![]() ��
��![]() ����C����
����C����
D.������Һ�к�![]() ��
��![]() ��
��![]() ��
��![]() ��������������Һ��ֻ��
��������������Һ��ֻ��![]() ����������D����
����������D����
�𰸣�B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ý�屨��������һ�ҹ�˾Tiamat��ǰ�з����ȵ�ǰ�㷺ʹ�õ�﮵�سɱ����͡���������������ٶȸ���������ӵ�أ�Ԥ�ƴ�2020�꿪ʼʵ�ֹ�ҵ�������õ�صĸ�������ΪNa2Co2TeO6���Ʊ�ԭ��ΪNa2CO3��Co3O4��TeO2�������ҺΪNaClO4��̼���ϩ����Һ���ش��������⣺
��1��Co ����Ԫ�����ڱ���______��Ԫ�أ����̬ԭ�ӵļ۵����Ų�ʽΪ______��
��2����̬Naԭ���У��������ռ�ݵ�ԭ�ӹ������Ϊ______������ܲ����������ͼ��״Ϊ_____
��3�����������Ϣ�жϣ�C��O��Cl�ĵ縺����С�����˳��Ϊ______����Ԫ�ط��ű�ʾ����
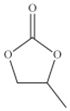
��4��ClO4 -�ļ��ι���Ϊ______��̼���ϩ���Ľṹ��ʽ��ͼ��ʾ��������̼ԭ�ӵ��ӻ��������Ϊ______��1mol̼���ϩ����![]() ������ĿΪ______��
������ĿΪ______��
��5��[Co��H2O��6]3+�ļ��ι���Ϊ���������Σ�������______���������Ӱ�����������Ϊ______����ѡ����ĸ����
A�����Ӽ�B��������C����λ��D�����E�����Լ�
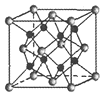
��6��Na��O�γɵ����ӻ�����ľ����ṹ��ͼ��ʾ��������O����λ��Ϊ______���þ������ܶ�Ϊ��g/cm3�������ӵ�������ֵΪNA����Na��O֮�����̾���Ϊ______nm���ú�����NA�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ػ������ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�á��ش��������⣺
��1�������Ǿ����۷��ӣ����ͽṹ�����з�����֤�������ǷǾ������_____��
A������ B��ԭ�ӷ������ C���˴Ź����� D��X�������䷨
��2����̬Asԭ�ӵĺ�������Ų�ʽΪ_____��Asԭ�ӵ��������������£�
��һ������ | �ڶ������� | ���������� | ���ĵ����� | ��������� | ���������� |
947.0 | 1798 | 2735 | 4837 | 6043 | 12310 |
Ϊʲô�����������������������ϴ�_____��
��3�����������Ͷ�ά�뵼����ϣ�����Ƭ��ṹ������ͼ��ʾ����Pԭ�ӵ��ӻ���ʽΪ_____�������֮��������Ϊ_____��

��4��GaAs���۵�Ϊ1238�棬������״̬�����磬�侧���ṹ����ͼ��ʾ���þ��������Ϊ_____��ÿ��Asԭ����Χ�����Asԭ����ĿΪ_____����ͬһ��Gaԭ�Ӿ��������Asԭ�ӹ��ɵĿռ乹��Ϊ_____��һ��GaAs��������λ������ĿΪ_____��

��5����֪GaAs���ܶ�Ϊdg/cm3��Ħ������ΪMg/mol�������ӵ�������NA��ʾ�����������As��Gaԭ�Ӻ˼��Ϊ_____ nm����ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Licht�ȿ�ѧ����Ƶ�Al��MnO4�����ԭ����ͼ��ʾ������ܷ�ӦΪAl��MnO4��===AlO2����MnO2������˵����ȷ����(�� ��)

A. ��ع���ʱ��K�������ƶ�
B. Al�缫������ԭ��Ӧ
C. �����ĵ缫��ӦʽΪMnO4����4H����3e��===MnO2��2H2O
D. �����ϵ�·��ÿͨ��1mol���ӣ�����������С9g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ǿ����Դ���⣬�Ӻ�ˮ����ȡʳ�κ���Ĺ�����ͼ��ʾ����������������ǣ�
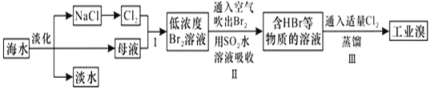
A. ������ˮ�ķ�����Ҫ�������������������ӽ�����
B. ��NaClΪԭ�Ͽ��������ռ��������ơ�����������Ȼ�����Ʒ
C. ������й����ȿ��������壬����Ϊ���������ܶȱȿ������ܶ�С
D. ��SO2ˮ��Һ����Br2�����ӷ�Ӧ����ʽΪ��Br2+SO2+2H2O�T4H++SO42��+2Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() þ���Ͻ���뵽
þ���Ͻ���뵽![]() ϡ�����У�ǡ����ȫ��Ӧ���ռ�����ԭ����NO����
ϡ�����У�ǡ����ȫ��Ӧ���ռ�����ԭ����NO����![]() ��״�������跴Ӧ�л�ԭ����ֻ��
��״�������跴Ӧ�л�ԭ����ֻ��![]() ����������Һ�м���
����������Һ�м���![]() ��Һ
��Һ![]() �����������ܽ⣬�����й������������
�����������ܽ⣬�����й������������
A.�Ͻ���Al����������ԼΪ![]()
B.ԭϡ�����Ũ��Ϊ![]()
C.��Ӧ���ղ�������![]()
D.�����������Ļ��Һ�еμ�![]() ϡ���ᣬ�����ij�����ȫ�ܽ�
ϡ���ᣬ�����ij�����ȫ�ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ��ķ�ӦΪN2(g)��3H2(g)![]() 2NH3(g)����֪���л�ѧ���ļ��ܣ�
2NH3(g)����֪���л�ѧ���ļ��ܣ�
��ѧ�� | ����kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
����˵����ȷ����
A. �÷�ӦΪ���ȷ�ӦB. �÷�Ӧ�з�Ӧ��������������������������
C. ��Ӧ����H��92 kJ��mol��1D. ����1 mol NH3�ų�92 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ��2 L���ܱ������м���4 mol A��2 mol B���з�Ӧ��3A(g)��2B(g) ![]() 4C(��)��2D(��)����Ӧһ��ʱ���ﵽƽ�⣬�������1.6 mol C���ҷ�Ӧǰ���ѹǿ֮��Ϊ5��4(��ͬ���¶��²���)��������˵����ȷ����(����)
4C(��)��2D(��)����Ӧһ��ʱ���ﵽƽ�⣬�������1.6 mol C���ҷ�Ӧǰ���ѹǿ֮��Ϊ5��4(��ͬ���¶��²���)��������˵����ȷ����(����)
A.�÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��K�� B.��ʱ��B��ƽ��ת������35%
B.��ʱ��B��ƽ��ת������35%
C.�������ϵ��ѹǿ��ƽ�������ƶ�����ѧƽ�ⳣ������D.����C��B��ƽ��ת���ʲ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com