
| A. | ①②④⑤⑥ | B. | ④⑤⑥ | C. | ②④⑤ | D. | ②③ |
分析 形成配位键应满足:中心原子或离子含有空轨道、配体含有孤对电子.
解答 解:①氢离子含有空轨道,氢氧根离子含有孤对电子,二者反应形成配位键;
②分子转化为原子,H原子与氧原子各提供1个电子形成共价键,没有配位键形成;
③氢离子含有空轨道,氨气分子含有孤对电子,通过配位键形成铵根离子;
④发生复分解反应,形成离子键,没有配位键形成;
⑤发生置换反应,没有配位键形成,形成金属键;
⑥氢离子含有空轨道,NH2-含有孤对电子,通过配位键形成NH3,
故选:C.
点评 本题考查配位键形成,配位键配位键是一种特殊的共价键,成键的两个原子间的共用电子对是由一个原子单独提供的.形成配位键的条件是其中一个原子有孤电子对,另一个原子有接受孤电子对的“空轨道”.配位键用A→B表示,A是提供孤电子对的原子,B是接受孤电子对的原子.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、HCO3-、Cl- | B. | K+、Fe2+、Cl-、OH- | ||
| C. | Ag+、Al3+、NO3-、H+ | D. | Fe3+、Al3+、SCN-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热的方法区分纯碱和小苏打 | |
| B. | 用量筒量取5.0mL浓硫酸,并直接加水稀释 | |
| C. | 用分液漏斗分离苯和水的混合物 | |
| D. | 用托盘天平称量药品时,左盘放物品,右盘放砝码 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
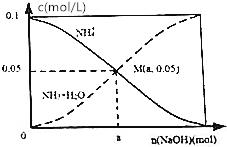 常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )
常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(0H-)-n(H+)=(a-0.05)mol | |
| C. | 随着Na0H的加入,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$不断减小 | |
| D. | 当n(NaOH)=0.1mol时,c(0H-)>c(C1-)>c(NH3•H20) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
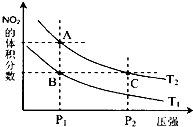 对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是bc.
对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是bc.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 紫色石蕊试液中滴入氢硫酸变红的原因是:H2S?2H++S2- | |
| C. | 等物质的量的MgCl2、Ba(OH)2和 HC1溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com