
某兴趣小组设计如下微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一 段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是 ( )
段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是 ( )
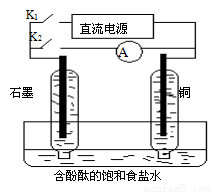
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl- Cl2↑+H2↑
Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl—
D.断开K1,闭合K2时,石墨电极作正极
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年辽宁省葫芦岛市六校协作体高二上期初考试化学卷(解析版) 题型:选择题
如图所示是气体性质实验的常用装置,下列有关实验现象的说法不正确的是( )

A.若水槽中是水,试管中是NO2,可看到液面上升,若充入一定量的O2可使液体充满整个试管
B.若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升、试管中黄绿色褪去
C.若水槽中是水并滴有几滴紫色石蕊,试管中是SO2,可看到液面上升并变为无色
D.若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并呈红色
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上9月月考化学试卷(解析版) 题型:选择题
下列有关物质性质的说法正确的是
A. 热稳定性:H2S>HCl B. 离子半径:Na+>F—
C. 酸性:H2SO4>HClO4 D. 离子还原性:S2—>Cl—
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省许昌市五校高二上学期第一次联考化学试卷(解析版) 题型:选择题
下列离子方程式的书写正确的是:( )
A.漂白粉溶液中通入SO2气体 Ca2+ + 2ClO- + SO2 + H2O = CaSO3↓+ 2HClO
B.碳酸氢钙溶液中加入过量的氢氧化钠溶液 HCO3- + OH- = CO32- + H2O
C.明矾溶液中加入过量的Ba(OH)2溶液 2Al3++3SO42-+3Ba2++6OH‑ = 3BaSO4↓+2Al(OH)3↓
D.过量的NH4HSO4溶液与Ba(OH)2溶液反应2H++ SO42- + Ba2+ + 2OH- = BaSO4↓+ 2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期9月调研化学试卷(解析版) 题型:推断题
甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。
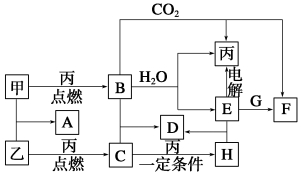
请回答下列问题:
(1)用化学式表示:丙为__________,H为__________。
(2)A的电子式为________________________________。
(3)电解E的水溶液时,E起到的作用是_______________________
(4)写出B+C―→D的化学方程式______________________________
写出E+G―→F的离子方程式___________________________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期9月调研化学试卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A.三氯化铝溶液中加入过量氨水:Al3++3OH--=Al(OH)3↓
B.4mol·L-1的NaAlO2溶液和7mol·L-1的HCl等体积互相均匀混合:4AlO2--+7H++H2O=3Al(OH)3↓+Al3+
C.K37ClO3与浓盐酸(HCl)在加热时生成氯气:K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O
D.将25mL0.lmol·L-1盐酸缓缓滴入25mL0.1mol·L-1Na2CO3溶液中,并不断搅拌:2H++CO32--=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期9月调研化学试卷(解析版) 题型:选择题
硬脂酸甘油酯经皂化反应后,得到硬脂酸钠和甘油。欲分离出硬脂酸钠,应采用的方法是:①用滤纸过滤 ②用分液漏斗分液 ③加热蒸发 ④加入热的饱和食盐水( )
A.④③ B.④② C.①③ D.④①
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期初考试化学卷(解析版) 题型:选择题
如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法错误的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法错误的是

A.达到平衡时,甲容器中C的物质的量大于乙容器中C的物质的量
B.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
C.达到平衡后,隔板K最终停留在左侧刻度0~1之间
D.若平衡时K停留在左侧1处,则活塞仍停留在右侧6刻度的右侧
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上9.4周考化学卷(解析版) 题型:填空题
与c(H+)c(OH-)=Kw类似,FeS饱和溶液中c(Fe2+)c(S2-)=Ksp(FeS)。常温下Ksp= (FeS)=8.1×10-17
(1)理论上FeS的溶解度为_______g, 而事实上其浓度远大于这个数值,其原因可能__________。
(2)己知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:c2(H+) c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到lmol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)为________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com