
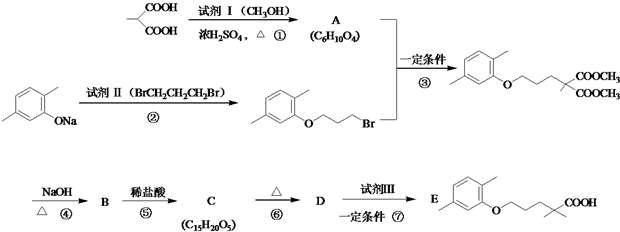
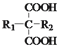 $\stackrel{△}{→}$
$\stackrel{△}{→}$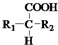 +CO2↑(R1和R2代表烷基)
+CO2↑(R1和R2代表烷基)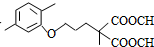 $\stackrel{△}{→}$
$\stackrel{△}{→}$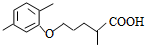 +CO2↑.
+CO2↑.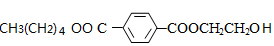 ,则X与Y发生缩聚反应所得缩聚物的结构简式是
,则X与Y发生缩聚反应所得缩聚物的结构简式是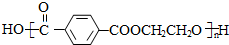 .
. 分析 (1)试剂I的结构简式为CH3OH,名称是甲醇;试剂Ⅱ的结构简式为BrCH2CH2CH2Br,含有的官能团为溴原子;对比 、
、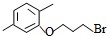 、BrCH2CH2CH2Br的结构可知,反应②属于取代反应;E的结构简式计算所含碳原子、氢原子和氧原子数写出分子式,E分子中共平面的碳原子数最多是依据苯环结构和烷烃结构分析判断;
、BrCH2CH2CH2Br的结构可知,反应②属于取代反应;E的结构简式计算所含碳原子、氢原子和氧原子数写出分子式,E分子中共平面的碳原子数最多是依据苯环结构和烷烃结构分析判断;
(2)反应①是CH3CH(COOH)2与CH3OH发生酯化反应生成CH3CH(COOCH3)2;
(3)试剂Ⅱ与足量NaOH溶液共热后的产物F为二元醇,F经催化氢化后反应生成醛,可发生银镜反应,分子中含两个醛基和银氨溶液反应生成酸盐、银、氨气和水;
(4)反应④在碱性条件下发生酯的水解反应生成B,B酸化生成C,则C为 ,结合信息可知D
,结合信息可知D ;
;
(5)第⑦步反应中,试剂Ⅲ为单碘代烷烃,对比D、E的结构简式可知试剂Ⅲ为CH3I;
(6)C的分子式为C15H20O5,其同分异构体H在酸性条件下水解,说明含有酯基,生成X、Y和CH3(CH2)4OH,生成物X含有羧基和苯环,且X和Y的核磁共振氢谱均只有两种类型的吸收峰,则X为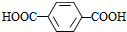 ,Y为HOCH2CH2OH,H结构简式为
,Y为HOCH2CH2OH,H结构简式为 ,依据二元羧酸和二元醇反应原理写出缩聚产物.
,依据二元羧酸和二元醇反应原理写出缩聚产物.
解答 解:(1)试剂I的结构简式为CH3OH,名称是甲醇;试剂Ⅱ的结构简式为BrCH2CH2CH2Br,含有的官能团为溴原子;对比 、
、 、BrCH2CH2CH2Br的结构可知,反应②属于取代反应,E的结构简式计算所含碳原子、氢原子和氧原子数写出分子式为C15H22O2,E分子中含苯环、羧基、烷烃结构,分析可知共平面的碳原子数最多是13个,
、BrCH2CH2CH2Br的结构可知,反应②属于取代反应,E的结构简式计算所含碳原子、氢原子和氧原子数写出分子式为C15H22O2,E分子中含苯环、羧基、烷烃结构,分析可知共平面的碳原子数最多是13个,
故答案为:溴原子;取代反应;C15H22O2;13;
(2)反应①是CH3CH(COOH)2与CH3OH发生酯化反应生成CH3CH(COOCH3)2,反应方程式为:CH3CH(COOH)2+2CH3OH$?_{△}^{浓硫酸}$CH3CH(COOCH3)2+2H2O,
故答案为:CH3CH(COOH)2+2CH3OH$?_{△}^{浓硫酸}$CH3CH(COOCH3)2+2H2O;
(3)试剂Ⅱ为BrCH2-CH2-CH2Br,与足量NaOH溶液共热后的产物F为二元醇,反应的化学方程式为:BrCH2-CH2-CH2Br+2NaOH→HOCH2-CH2-CH2OH+2NaBr,得到物质的名称为:1.3-丙二醇,
F经催化氢化后反应生成醛,结构简式为:OHC-CH2-CHO,可发生银镜反应,分子中含两个醛基和银氨溶液反应生成酸盐、银、氨气和水,反应的化学方程式为:
OHC-CH2-CHO+4Ag(NH3)2OH$\stackrel{△}{→}$H4NOOC-CH2COONH4+4Ag+6NH3+2H2O,
故答案为:1.3-丙二醇;OHC-CH2-CHO+4Ag(NH3)2OH$\stackrel{△}{→}$H4NOOC-CH2COONH4+4Ag+6NH3+2H2O;
(4)反应④在碱性条件下发生酯的水解反应生成B,B酸化生成C,则C为 ,结合信息可知D
,结合信息可知D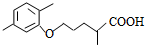 ,第⑥步反应的化学方程式是:
,第⑥步反应的化学方程式是:
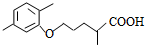 +CO2↑,
+CO2↑,
故答案为: $\stackrel{△}{→}$
$\stackrel{△}{→}$ +CO2↑;
+CO2↑;
(5)第⑦步反应中,试剂Ⅲ为单碘代烷烃,对比D、E的结构简式可知试剂Ⅲ为CH3I,
故答案为:CH3I;
(6)C的分子式为C15H20O5,其同分异构体在酸性条件下水解,说明含有酯基,生成X、Y和CH3(CH2)4OH,生成物X含有羧基和苯环,且X和Y的核磁共振氢谱均只有两种类型的吸收峰,则X为 ,Y为HOCH2CH2OH,则H的结构简式为
,Y为HOCH2CH2OH,则H的结构简式为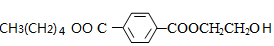 ,X和Y发生缩聚反应所得缩聚物的结构简式是:
,X和Y发生缩聚反应所得缩聚物的结构简式是: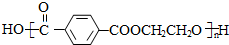 ,
,
故答案为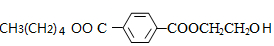 ;
;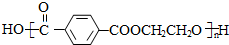 .
.
点评 本题考查有机合成和有机推断,涉及有机物的命名、官能团的识别、反应类型的判断、同分异构体、化学方程式的书写等,是对有机化学基础的综合考查,侧重考查学生分析推理能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ③①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
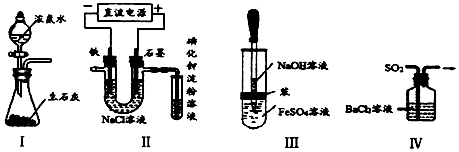
| A. | 实验Ⅰ:所示装置可制备氨气 | |
| B. | 实验Ⅱ:检验电解饱和食盐水的产物C12 | |
| C. | 实验Ⅲ:制取并观察Fe(OH)2沉淀 | |
| D. | 实验Ⅳ:吸收SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
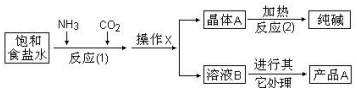
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
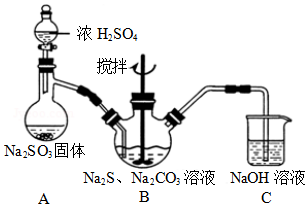
| 实验次数 | 样品溶液体积(mL) | 滴定消耗0.100mol/L碘溶液体积(mL) |
| 1 | 20.00 | 9.80 |
| 2 | 20.00 | 10.70 |
| 3 | 20.00 | 9.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积数据 | B. | 体积分数 | C. | 质量分数 | D. | 物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 步骤 | 操作 | 现象 |
| 1 | 加入稀盐酸 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com