
| A. | 降低温度 | B. | 用铁代替锌 | C. | 增大盐酸浓度 | D. | 用锌粒代替锌粉 |
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:解答题
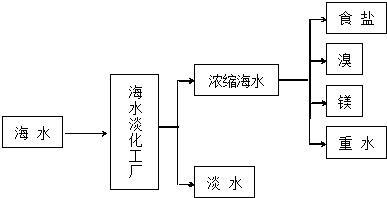
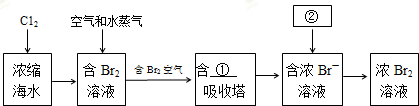
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,臭氧和氧气都是无色气体 | |
| B. | 臭氧与氧气可以相互转化,其反应属于氧化还原反应 | |
| C. | 臭氧具有极强的氧化性,可以将 Ag、Hg 等不活泼金属氧化 | |
| D. | 臭氧是一种很好的消毒剂,空气中存在大量的臭氧有利于人体健康 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该化合物中含有极性共价键(填“极性”或“非极性”).
,该化合物中含有极性共价键(填“极性”或“非极性”).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
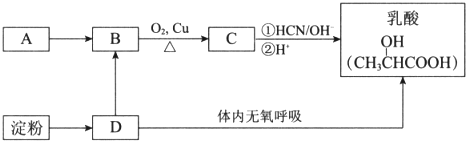
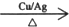 2CH3CHO+2H2O.
2CH3CHO+2H2O.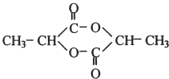 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
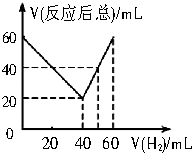 某气态不饱和链烃CnHm与H2反应生成CnHm+n,取CnHm和H2混合气体共60mL进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积数也不同.反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温同压下测定).由此可知n的数值是( )
某气态不饱和链烃CnHm与H2反应生成CnHm+n,取CnHm和H2混合气体共60mL进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积数也不同.反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温同压下测定).由此可知n的数值是( )| A. | 2 | B. | 4 | C. | 6 | D. | 8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com