
| A. | 纯水100℃和25℃的pH值 | |
| B. | Na2CO3溶液中HCO3-和OH-数目 | |
| C. | 100mL0.1mol/L的CH3COOH溶液与10mL1.0mol/L的CH3COOH溶液中H+数目 | |
| D. | 同温下pH=11的KOH与pH=3的CH3COOH溶液中由水电离出的OH-离子浓度 |
分析 A.水的电离是吸热反应,升高温度促进水电离,根据溶液中氢离子浓度大小判断;
B.碳酸钠水解分两步进行,第一步水解生成碳酸氢钠和氢氧化钠,第二步水解生成碳酸和氢氧化钠,据此分析两种离子浓度大小;
C.相同温度相同溶质的弱电解质溶液中,溶液越稀,电解质的电离程度越大;
D.根据水的电离程度分析,酸或碱抑制水电离,酸中氢离子、碱溶液中氢氧根离子浓度越大,抑制程度越大.
解答 解:A.水的电离是吸热反应,温度越高,水的电离程度越大,则其pH越小,故A错误;
B.碳酸根离子的两步水解中都产生氢氧根离子,只有碳酸根离子的第一步水解中生成碳酸氢根离子,所以碳酸氢根离子数目小于氢氧根离子数目,故B错误;
C.相同温度相同溶质的弱电解质溶液中,溶液越稀,电解质的电离程度越大,所以0.01mol/L的CH3COOH大于1 0.1mol/L的CH3COOH的电离程度,且二者的物质的量相等,所以100mL0.01mol/L的CH3COOH溶液大于10mL 0.1mol/L的CH3COOH溶液的H+数目,故C正确;
D.同温下pH=11的KOH溶液中氢氧根离子浓度为0.001mol/L,氢氧化钾溶液中的氢离子是水电离的,水电离的氢氧根离子为:1×10-11mol/L,
pH=3的CH3COOH溶液中氢离子浓度为0.001mol/L,醋酸中氢氧根离子是水电离的,则水电离的氢氧根离子浓度为1×10-11mol/L,所以两溶液中水电离的氢氧根离子浓度相等,故D错误;
故选C.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确盐的水解原理、弱电解质的电离平衡的影响因素为解答关键,试题培养了学生的分析、理解能力灵活应用能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol的-OH含有的电子数为NA | |
| B. | 9.2 g甲苯分子中处于同一平面的原子数最多为1.3NA | |
| C. | 标准状况下,2.8 g乙烯分子中含有的单键数为0.5NA | |
| D. | 标准状况下,2.24 L戊烷所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
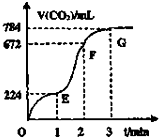 用纯净的CaCO3与100mL稀盐酸制取CO2实验过程记录如图(CO2的体积已折算成标准状态下的数值).下列分析错误的是( )
用纯净的CaCO3与100mL稀盐酸制取CO2实验过程记录如图(CO2的体积已折算成标准状态下的数值).下列分析错误的是( )| A. | 第1到第2分钟间混合物质质量减少最快 | |
| B. | EF段中,用盐酸表示该反应的平均速率为0.4mol•L-1•min-1 | |
| C. | OE、EF、FG三段中用CO2表示该反应的平均速率之比为2:4:1 | |
| D. | FG段溶液质量增加比EF段溶液质量增加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2Y<HZ | B. | 原子半径:W>X>Z>Y | ||
| C. | 离子半径:W2+>Y2- | D. | 碱性:XOH<W(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
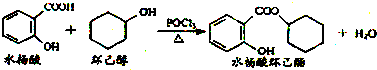
| A. | 水杨酸能分别与NaHCO3、Na2CO3溶液反应,且1 mol水杨酸分别消耗NaHCO32mol、Na2CO31mol | |
| B. | 水杨酸、环己醇和水杨酸环己酯均能与FeCl3溶液发生显色反应 | |
| C. | 1 mol水杨酸环己酯在NaOH溶液中水解时,最多消耗3 mol NaOH | |
| D. | 1 mol水杨酸跟足量浓溴水反应时,最多消耗Br2 2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Na+)>c(CH3COO-) | B. | c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | ||
| C. | c(Na+)<c(CH3COO-) | D. | c(Na+)<c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H、C、O、N、S、Cl是常见的几种非金属元素.
H、C、O、N、S、Cl是常见的几种非金属元素. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | -2 | C. | +1 | D. | 0? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中的氧化剂只有Cu2O | |
| B. | 氧化产物和还原产物的物质的量之比为6:1 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | Cu2S在反应中既是氧化剂又是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com