
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液的pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法错误的是
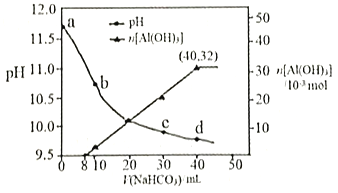
A. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+c(OH-)
B. 水的电离程度:a点小于c点
C. 原 NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8mol·L-1
D. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
【答案】C
【解析】
根据题意可知a点为偏铝酸钠和氢氧化钠混合溶液,0mL~8mL碳酸氢钠与过量的氢氧化钠反应,8mL~32mL碳酸氢钠与偏铝酸钠反应,据此分析选项是否正确。
A.a点为偏铝酸钠和氢氧化钠混合溶液,根据电荷守恒可以写出:c(Na+)+c(H+)=c(AlO2-)+c(OH-),A正确;
B.水的电离程度:a点为偏铝酸钠和氢氧化钠的混合液, c点为偏铝酸钠与碳酸钠的混合液,因为酸碱抑制水的电离,盐类水解促进水的电离,所以水的电离程度:a点小于c点,B正确;
C.加入40mLNaHCO3溶液时沉淀最多,沉淀为0.032mol,前8mLNaHCO3溶液和氢氧化钠反应(OH-+HCO3-=CO32-+H2O)不生成沉淀,后32mLNaHCO3溶液与偏铝酸钠反应(HCO3-+AlO2-+H2O═Al(OH)3↓+CO32-)生成沉淀,则原NaHCO3溶液物质的量浓度c(NaHCO3)=![]() =1.0mol/L,原NaHCO3溶液中的物料守恒为c(HCO3-)+c(CO32-)+c(H2CO3)=1.0mol/L,C错误;
=1.0mol/L,原NaHCO3溶液中的物料守恒为c(HCO3-)+c(CO32-)+c(H2CO3)=1.0mol/L,C错误;
D.根据强酸制弱酸原理可以写出离子方程式HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-,D正确;
正确答案:C。


科目:高中化学 来源: 题型:
【题目】一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3、FeO及SiO2等)为原料制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如下:

(1)配料中属于两性氧化物的是______,步骤Ⅱ酸溶时,Fe2O3被溶解的化学方程式为_____。
(2)“滤渣1”的主要成分为________ (填化学式),为检验“过滤1”后的溶液中是否含有Fe3+,可选用的化学试剂是_________。
(3)步骤Ⅳ加入H2O2溶液的目的是______,发生反应的离子方程式为__。
(4)步骤Ⅴ调节pH=3发生反应生成聚合碱式氯化铝铁,若溶液pH过大,可能造成的影响是_________;步骤Ⅵ包含的操作有过滤、________、干燥得到产品。
(5)测定聚合碱式氯化铝铁{可表示为[FeaAlb(OH)xCly]n}中n(Fe)/n(Al)的比值的步骤如下:
步骤1:准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350g固体。
步骤2:另准确称取相同质量样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.8000g。
计算产品中n(Fe)/n(Al)的比值。(写出计算过程)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片、铜片用导线连接后,置于稀硫酸中,形成原电池,
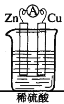
其正极反应式:_________________________;负极反应式: ____________;总反应方程式:_________________。若反应过程中有0.2mol电子发生转移,则生成的氢气在标准状况下的体积为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g) ![]() FeO(s)+CO(g),其平衡常数为K1;化 反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化 反应②:Fe(s)+H2O(g) ![]() FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1173 K | 2.15 | 1.67 |
请填空:(1)通过表格中的数值可以推断:K1随温度的升高而____________,(填增大,减小,不变),所以反应①是____________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g) ![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的数表达式:K3=__________,根据数据可知反应③是吸热反应。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数表达式:K3=__________,根据数据可知反应③是吸热反应。
(3)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有___(填写字母序号,下同)。
A.增大压强(压缩容器体积)
B.体积不变时充入稀有气体
C.升高温度
D.使用合适的催化剂
(4)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件可能是_____________ 、____________。
②图乙中t2时刻发生改变的条件可能是__________。
A.升高温度 B.降低温度 C.加入催化剂 D.增大压强 E.减小压强 F.充入CO2 G.分离出部分CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法错误的是
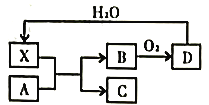
A. X使蔗糖变黑的现象主要体现了X的脱水性
B. 若A为铁,则在图中的反应,X只起氧化的作用
C. 若A为碳单质,则C不宜用来扑灭由钠引起的着火
D. 将B气体通入品红溶液中,品红溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航空和电器行业中使用的垫圈多为橡胶,制作这些垫圈的橡胶必须具备耐高温、耐低温、耐氧化等特点。下列橡胶可用于制作航空和电器行业中的垫圈的是( )
A.天然橡胶B.丁苯橡胶C.氯丁橡胶D.有机硅橡胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V2-、W3-、X2+、Y2-、Z-是由短周期元素形成的简单离子,其中V2-、W3-、X2+均是10电子的微粒,Y2-、Z-与Ar原子具有相同的电子数。(请用化学用语回答下列问题)
(1)V2-的结构示意图为___________。
(2)V、W、X的原子半径由小到大的顺序是______________________。
(3)无水W2H4为无色液体,在298k时与V2气体迅速反应生成W2气体和液态的V的最简单氢化物,若生成1mol该液态氢化物放出311.2kJ热量,则该反应的热化学方程式为_________________________________。
(4)YZ2是一种重要的化工产品,熔点:-78℃,沸点:59.6℃,加热至40℃以上,部分开始分解,YZ2晶体属于___________晶体。
(5)①Na2YO3溶液中离子浓度从大到小的顺序是_________________________。
②已知:室温下H2YO3的电离平衡常数Ka1=1.4×10-2,Ka2=6.3×10-8,请通过计算确定NaHYO3水溶液的酸碱性(请写出计算过程)_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知

A. X、Y、Z中最简单氢化物稳定性最弱的是Y
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X元素形成的单核阴离子还原性大于Y
D. Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)
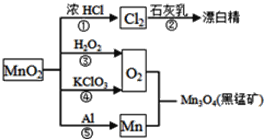
A. 反应⑤说明该条件下铝的还原性强于锰
B. 反应①②③④⑤均属于氧化反应和离子反应
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D. 反应①中氧化剂与还原剂的物质的量之比为1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com