
【题目】观察如图,回答问题:
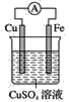
(1)该装置叫__装置,可以将__能转化为__能。
(2)负极是__,电极反应式为__。
(3)正极是__,电极反应式为__。
(4)电池总反应的离子方程式为__。
【答案】原电池 化学 电 铁(Fe) Fe-2e-=Fe2+ 铜(Cu) Cu2++2e-=Cu Fe+Cu2+=Cu+Fe2+
【解析】
该装置为原电池,可将化学能转化为电能。根据两极金属相对活动性可确定铁为负极,铜为正极;负极金属本身失去电子,发生氧化反应:Fe-2e-=Fe2+;溶液中的阳离子在正极上得电子,发生还原反应:Cu2++2e-=Cu。正、负极反应式相加,可得电池总反应的离子方程式为Fe+Cu2+=Cu+Fe2+。
(1)装置没有外接电源,故为原电池,将化学能转化为电能,
故答案为:原电池;化学;电;
(2)铁比较活泼,负极是铁电极,电极方程式为Fe-2e-=Fe2+,
故答案为:铁,Fe-2e-=Fe2+;
(3)正极是铜电极,电极方程式为Cu2++2e-=Cu,
故答案为:铜,Cu2++2e-=Cu;
(4)将正负极电极方程式相加得电池总反应的离子方程式为Fe+Cu2+=Cu+Fe2+,
故答案为:Fe+Cu2+=Cu+Fe2+


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
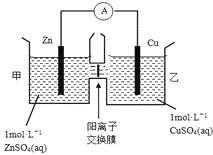
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜转炉烟灰主要含有Zn[还有少量的Fe(+2价)、Pb、Cu、As等元素]的硫酸盐和氧化物,少量为砷酸盐。制备重要化工原料活性氧化锌的工艺流程如图所示。请回答以下问题:
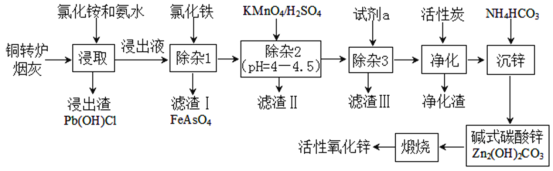
己知:活性炭净化主要是除去有机杂质。
(1)写出氯化铵的电子式___,“净化”过程属于___(填“物理”、“化学”)变化。
(2)在反应温度为50℃,反应时间为1h时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,则氯化铵适宜的浓度为___mol·L-1。若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___。

(3)滴加KMnO4溶液有MnO2生成,目的是除___元素,除杂3是置换除杂过程,则试剂a是___,“滤渣Ⅲ”的主要成分为___(填化学式)。
(4)写出“沉锌”时发生反应的离子方程式___,此过程中可以循环利用的副产品是___。
(5)取mg活性氧化锌样品配成待测液,加入指示剂3、4滴,再加入适量六亚甲基四胺,用amolL-1EDTA标准液进行滴定,消耗标准液VmL。己知:与1.0mLEDTA标准液[c(EDTA)=1.000mo1L-1]相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为___(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是短周期元素,在周期表中的位置关系如图所示,下列说法不正确的是
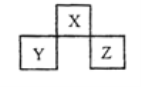
A.X、Z的原子序数之和与Y 的原子序数之比可能为5:3
B.X最简单的气态氢化物的稳定性一定高于Y的气态氢化物
C.Z单质的熔点一定高于Y单质
D.若Z的最高价氧化物为Z2O7,则Y的气态氢化物为YH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)直接燃料电池具有启动快、效率高等优点,用二甲醚燃料电池电解甲基肼(CH3—NH—NH2)制氢的装置如图所示,其中X、Y、M、N均为惰性电极。下列说法不正确的是

A.M极的电极反应式为CH3—NH—NH2+12OH-10e![]() CO32-+N2↑+9H2O
CO32-+N2↑+9H2O
B.乙中的交换膜是阴离子交换膜,OH透过交换膜向M极移动
C.若忽略水的消耗与生成,甲中电解质溶液的pH减小,乙中电解质溶液的pH增大
D.理论上,标况下当生成6.72 L H2时,消耗CH3OCH3的质量为2.3 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前汽车上使用的电瓶大多仍是铅蓄电池,其构造示意图如下。发生反应的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),下列说法不正确的是
2PbSO4(s)+2H2O(l),下列说法不正确的是
A. 放电时,电解质溶液的pH值增大
B. 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g
C. 放电时,溶液中H+向PbO2电极移动
D. 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常数的值为NA。下列说法正确的是
A.18 g H2O、D2O组成的物质中含有的电子数为10NA
B.0.2 mol铁在足量的氧气中燃烧,转移电子数为0.6NA
C.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
D.0.1 mol 熔融的KHSO4中含有0.1NA个阳离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com