
【题目】下列描述中正确的是( )
A.CS2为V形的极性分子
B.ClO3﹣ 的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO32﹣ 的中心原子均为sp3杂化
科目:高中化学 来源: 题型:
【题目】用特殊方法把固体物质加工到纳米级(1~10nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的微粒直径和这种粒子具有相同的数量级的是( )
A. 溶液 B. 悬浊液 C. 胶体 D. 乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物PTT是一种性能优异的新型纤维,是当前国际上最新开发的热门高分子新材料.PTT的一种合成路线如图: 
已知:R1CHO+R2CHCHO ![]()

(1)已知A→B是加成反应,B的结构简式为 , C分子中含有的官能团是
(2)用系统命名法给有机物D进行命名 .
(3)芳香烃E的相对分子质量为106,E的一氯代物只有2种,则E的结构简式为 .
(4)E→F的反应类型为反应,合成PTT的化学方程式为 .
(5)有机物I的同分异构体有很多种,写出同时符合下列条件的所有同分异构体的结构简式 .
①含有苯环 ②核磁共振氢谱有三个峰.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,发生反应:2X(g)+Y(g)Z(g)△H=﹣197kJmol﹣1 , 若将2mol X和1mol Y充入2L的恒容密闭容器中,反应10min,测得X的物质的量为1.4mol,下列说法正确的是( )
A.10min内,反应放出的热量为197kJ热量
B.10min内,X的平均反应速率为0.06molL﹣1min﹣1
C.第10min时,Y的反应速率小于0.015molL﹣1min﹣1(假如体系温度不变)
D.第10min时,Z浓度为0.6molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和苯都是重要的化工原料.下图是某有机物B合成的过程. 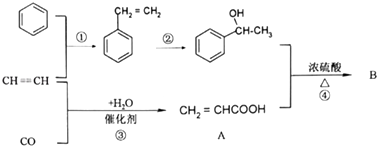
请回答:
(1)写出反应①的反应类型 , 反应②所加试剂 .
(2)关于物质A(CH2=CHCOOH)化学性质的说法正确的是 .
A.物质A含有一种官能团
B.物质A与Na2CO3溶液反应能产生气泡
C.物质A不能使酸性KMnO4溶液褪色
D.常温常压下,物质A呈气态
(3)反应④的反应机理与制取乙酸乙酯相似,写出其化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟企业对含铬废水(Cr2O72﹣和Cr3+)处理流程如图1 
已知:2CrO42﹣+2H+═Cr2O72﹣+H2O
请回答:
(1)用离子方程式表示调节池里发生的反应: .
(2)操作Ⅰ得到的残渣的化学式为 .
(3)操作Ⅲ调节pH时最适合作为调节剂的是 .
A.4molL﹣1盐酸
B.6molL﹣1硫酸
C.石灰乳
D.碳酸钠
(4)为检测处理后废水中铬的含量,取100mL处理后的样品于锥形瓶中,用浓醋酸调节pH=5,并加入适量固体抗坏血酸,使Cr2O72﹣完全转化为Cr3+ , 再用amolL﹣1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr2O72﹣→2Cr3+ , Cr3++Y4﹣=CrY﹣
①滴定时采用如图2所示的侧边自动定零位滴定管,具有的优点是 .
②实验消耗EDTA标准溶液b mL,则处理后废液中含铬浓度为mgL﹣1(用含a、b的式子表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份.将其中的一份直接加热至恒重,质量减轻了1.24g;另一份加入一定;量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24L气体,消耗盐酸40.0mL.试计算:
(1)原均匀混合物中NaHCO3的物质的量.n(NaHCO3)=mol.
(2)盐酸的浓度c(HCl)=mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com