
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| C. | NaClO和NaOH的混合溶液中通入少量的SO2:ClO-+H2O+SO2=C1-+SO42-+2H+ | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
分析 A.硝酸具有强的氧化性,能够氧化二价铁离子和硫离子;
B.氢氧化钠过量,铵根离子、碳酸氢根离子都反应;
C.次氯酸根离子具有强的氧化性,能够氧化硫酸根离子;
D.二者反应生成醋酸钙、二氧化碳和水.
解答 解:A.硝酸具有氧化性,能氧化FeS,因此产物应该是硝酸铁、硫酸和一氧化氮,离子方程式:3FeS+18H++9NO3-=3Fe3++3H2SO4+9NO↑+6H2O,故A错误;
B.NH4HCO3溶于过量的NaOH溶液中,离子方程式:NH4++HCO3-+2OH-=CO32-+H2O+NH3•H2O,故B错误;
C.NaClO和NaOH的混合溶液中通入少量的SO2,离子方程式:2OH-+ClO-+H2O+SO2=C1-+SO42-+2H2O,故C错误;
D.大理石溶于醋酸中,离子方程式:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,侧重考查复分解反应、氧化还原反应的离子方程式书写,明确物质的性质及发生反应实质是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
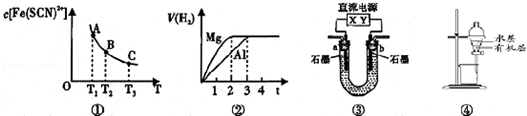
| A. | 已知图①是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)中的c[Fe(SCN)2+]与温度T的平衡图象,A点与B点相比,A点的c(Fe3+)更小 | |
| B. | 图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 | |
| C. | 图③直流电源Y极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:4OH--4e-═O2↑+2H2O | |
| D. | 图④表示分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/K | 300 | 400 | 500 | … |
| K/(mol•L-1)2 | 4×106 | 8×107 | K1 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含一种元素的物质一定是单质 | B. | 只含一种分子的物质一定纯净物 | ||
| C. | 非金属氧化物一定是酸性氧化物 | D. | 有单质生成的反应一定是置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正反应吸热,m+n>x | B. | 正反应吸热,m+n<x | ||
| C. | 正反应放热,m+n<x | D. | 正反应放热,m+n>x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此反应是氧化还原反应 | |
| B. | N2O4在反应中作还原剂 | |
| C. | 反应瞬间产生大量高温气体,推动火箭飞行 | |
| D. | R的分子式为C2H8N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
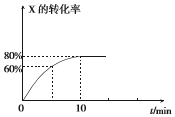 恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:
恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com