
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是____(填离子符号);实验①和③说明:在I-过量的情况下,
溶液中仍含有___(填离子符号),由此可以证明该氧化还原反应为________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是_______________;生成沉淀的原因是__________________(用平衡移动原理解释)。
【答案】 防止Fe2+被氧化 2Fe2++Cl2=2Fe3++2Cl- 隔绝空气(排除氧气对实验的影响) Fe2+ Fe3+ 可逆反应 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3+催化H2O2分解产生O2 H2O2分解反应放热,促进Fe3+的水解平衡正向移动
【解析】试题分析:(1)Fe2+容易被氧气氧化成Fe3+,Fe+2Fe3+=3Fe2+,为防止Fe2+被氧化,保存Fe2+时,加入铁屑;(2)氯气具有强氧化性,能把Fe2+氧化成Fe3+,因此离子反应方程式为2Fe2++Cl2=2Fe3++2Cl-;(3)为防止空气氧气进入,煤油的作用是隔绝空气;(4)K3[Fe(CN)6]检验Fe2+,如果出现蓝色沉淀,说明Fe2+存在,可逆反应特点是反应物和生成物共存,因此在I-过量,溶液中仍然存在Fe3+,说明此反应是可逆反应;(5)过氧化氢具有强氧化性,能把Fe2+氧化成Fe3+,本身被还原为H2O,因此离子反应方程式为:2Fe2+ +H2O2+2H+=2Fe3++2H2O,Fe3+作催化剂,加速过氧化氢的分解,根据实验现象,一段时间后有气泡冒出且放热,说明此反应是放热反应,Fe3++3H2O![]() Fe(OH)3+3H+,盐类水解是吸热反应,升高温度,促使平衡向正反应方向进行,因此有红褐色沉淀产生。
Fe(OH)3+3H+,盐类水解是吸热反应,升高温度,促使平衡向正反应方向进行,因此有红褐色沉淀产生。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 第4 、5 、6周期的副族元素均为10个
B. 第三和第四周期的相同主族元素的原子序数一定相差18
C. 117号元素可能是金属元素
D. 元素周期表中第四周期第VA族的元素与第三周期ⅡA元素核电荷数相差13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】外围电子构型为3d104s1的元素的原子在周期表中应位于
A. 第五周期ⅠB族 B. 第五周期ⅡB族
C. 第四周期ⅦB族 D. 第四周期ⅠB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的框图中,A~I都是由短周期元素组成的常见物质。其中A是气体,它的水溶液呈碱性;氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒;单质E可作半导体材料。
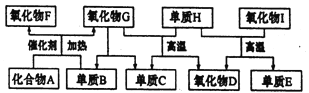
(1)化合物A的化学式是_________。
(2)组成单质E的元素在元素周期表中的位置是_________。
H+I反应的化学方程式为___________。
(3)标准状况下,将2.24L氧化物F和1.68L单质B同时通入1L氧化物G中(反应前后溶液体积的变化忽略不计),所得溶液的pH=__________。此时再向溶液中通入2.24L化合物A,完生反应后所得溶液的pH<7,用离子方程式表示其原因__________。
(4)单质B和单质C在一定条件下可组成原电池(用KOH溶液作电解质),则该原电池负极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,每一种物质都能使氯水褪色的是( )
A.AgNO3溶液、CCl4、BaCl2溶液 B.Na2SO3溶液、FeCl3溶液、H2S溶液
C.SO2气体、KOH溶液、镁粉 D.NaOH溶液、CO气体、石蕊溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象及所对应的离子方程式都正确的是( )

选项 | 现象 | 离子方程式 |
A | I在空气中放置一段时间后,溶液呈蓝色 | 4I-+O2+2H2O=2I2+4OH- |
B | II溶液由浅绿色变为红色 | Fe2++Cl2=Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3 |
C | III溶液 颜色无变化 | Cl2+2OH- = Cl-+ClO-+H2O |
D | IV有白色沉淀生成,溶液由红色变无色 | Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 2 -甲基丙烷也称异丁烷 B. 蔗糖和纤维素都属于髙分子化合物
C. 苯使溴水褪色是因为发生了取代反应 D. C3H6Cl2有3种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等。实验室模拟工业从粉煤灰提取活性Al2O3,其流程如下图:
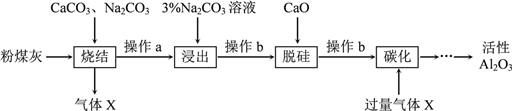
已知烧结过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。
(1)写出烧结过程中铝元素转化的化学方程式_________________________。
(2)操作a为冷却、研磨,其中研磨的目的是________________________。
(3)浸出过程中,NaFeO2可完全水解,水解反应的离子方程式为_______________。
(4)操作b的名称是_________,所用的玻璃仪器有___________、__________和烧杯。
(5)“碳化”时生成沉淀,沉淀的化学式为________________。
(6)上述过程中循环使用的物质是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com