
| A. | ①③⑤ | B. | ①② | C. | ①③ | D. | ②③⑤ |
分析 ①向饱和碳酸钠溶液中通入过量的CO2,析出晶体碳酸氢钠;
②氢氧化铁胶体滴入硫酸先聚沉生成沉淀氢氧化铁,继续滴入硫酸,氢氧化铁沉淀溶解;
③向NaAlO2溶液中通入过量的CO2,生成氢氧化铝,氢氧化铝与二氧化碳不反应;
④向 AlCl3溶液中加入 Ba(OH)2溶液至过量,先生成氢氧化铝,然后生成偏铝酸钠;
⑤向CaCl2溶液中通入 CO2,不反应.
解答 解:①向饱和碳酸钠溶液中通入过量的CO2,二氧化碳和碳酸钠反应生成碳酸氢钠,碳酸氢钠的溶解性小于碳酸钠的溶解性,所以向饱和碳酸钠溶液中通入过量二氧化碳后溶液中会产生碳酸氢钠沉淀,但沉淀不溶解,故①选;
②向Fe(OH)3胶体中逐滴加入过量的稀硫酸,先胶体和电解质溶液产生聚沉现象,有沉淀生成;后氢氧化铁又和硫酸反应生成水和可溶性的硫酸铁,所以沉淀又溶解,故②不选;
③向NaAlO2溶液中通入过量的CO2,生成氢氧化铝,氢氧化铝与二氧化碳不反应,沉淀不溶解,故③选;
④向 AlCl3溶液中加入 Ba(OH)2溶液至过量,先生成氢氧化铝,然后生成偏铝酸钠,先产生沉淀,然后沉淀又溶解,故④不选;
⑤因碳酸的酸性比盐酸弱,向CaCl2溶液中通入 CO2,不反应,故⑤选.
故选A.
点评 本题以能发生“先沉淀后溶解”现象为载体主要考查相关物质的性质,为高频考点,侧重考查学生的分析能力,根据物质的性质结合反应原理分析本题即可,需要注意的是胶体的性质.题目难度中等.


科目:高中化学 来源: 题型:实验题
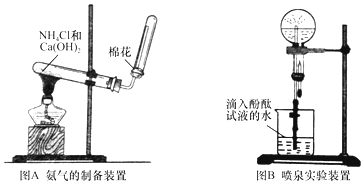
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,增加反应物的量,必定加快反应速率 | |
| B. | 升高温度正反应速率增大,逆反应速率也增大 | |
| C. | 可逆反应的特征是正反应速率总是和逆反应速率相等 | |
| D. | 增大压强一定会加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3CuS+8HNO3═3Cu(NO3)2+2NO↑+3S↓+4H2O | |
| B. | Br2+2KOH═KBr+KBrO+H2O | |
| C. | 3H2O2+2KCrO2+2KOH═2K2CrO4+4H2O | |
| D. | 3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | Cl2通入NaOH溶液中:Cl2+OH-═Cl-+ClO-+H2O | |
| C. | 二氧化氮与水反应:3NO2+H2O═2H++2NO3-+NO | |
| D. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 向氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 氯化亚铁溶液中通入少量氯气:Cl2+2Fe2+═2Fe3++2Cl- | |
| D. | 往明矾溶液中滴加Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++2SO42-+Al3++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com