
| A. | K+、MnO4-、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CO32- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Na+、SO42-、Cl-、NH4+ |
科目:高中化学 来源: 题型:选择题
| A. | 制普通玻璃的主要原料是烧碱、石灰石、石英 | |
| B. | SiO2是光导纤维的主要成分,晶体硅可用于制作半导体材料 | |
| C. | 实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液 | |
| D. | 盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是物质的量的单位,含有6.02×1023个微粒的物质叫做1摩尔 | |
| B. | 1mol氧含有6.02×1023个氧原子 | |
| C. | 1mol气体的体积随压强增大和温度降低而变小 | |
| D. | 标准状况下,体积相等的CCl4和Cl2,前者含有的氯原子数是后者的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
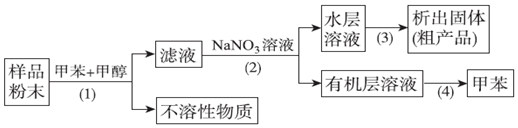
| A. | 步骤(1)需要过滤装置 | |
| B. | 步骤(3)需要用到蒸发皿 | |
| C. | 活性天然产物易溶于有机溶剂难溶于水 | |
| D. | 步骤(4)是利用物质沸点差异进行分离的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有无色、刺激气味气体产生 | |
| B. | 有白色沉淀生成 | |
| C. | 有红褐色沉淀生成 | |
| D. | 有白色沉淀生成,很快变成灰绿色,最后变为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 两试管各加入5ml 0.1mol/L Na2S2O3溶液,同时分别滴入5ml 0.1mol/L硫酸和盐酸 | 两支试管同时变浑浊 | 其它条件不变时,Cl-一定有催化效果 |
| C | A1箔插入稀HNO3中 | 无现象 | A1箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(N2)=0.01mol/(L•S) | B. | V(H2)=0.2mol/(L•S) | ||
| C. | V(H2)=0.6mol/(L•min) | D. | V(NH3)=1.2mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放电时:电子移动方向由Pb通过导线向PbO2传递 | |
| B. | 充电时:阳极反应是PbSO42-+2e-+2H2O═PbO2+SO42-+4H+ | |
| C. | 放电时:正极反应是Pb-2e-+SO42-═PbSO4 | |
| D. | 充电时:铅蓄电池的阴极应与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 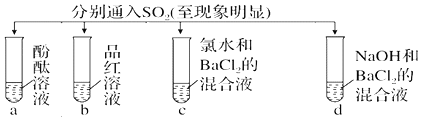 | ||||
| 现象 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 无色 | 无色 | 溶液变无色,白色沉淀 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com