
【题目】某化学课外活动小组通过实验探究NO2的性质。已知:2NO2+2NaOH===NaNO3+NaNO2+H2O。
任务1:利用如图所示装置探究NO2能否被NH3还原(夹持固定装置已略去)。

请回答下列问题:
(1)E装置中制取NO2的化学方程式是_____________________________。
(2)若NO2能被NH3还原,预期观察到C装置中的现象是________________。
(3)此实验装置存在的一个明显缺陷是_______________________________________。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(4)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:________________________________________________。
(5)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。
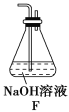
①装置的合理连接顺序是(某些装置可以重复使用)_________________。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中发生反应的化学方程式为______________________。
【答案】Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O 气体颜色逐渐变浅 缺少尾气处理装置 NO2能被Na2O2还原 E→D→B→D→F 2NO2+Na2O2===2NaNO3
【解析】
(1)E装置中浓硝酸与铜片发生反应生成NO2,反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(2)A装置用于制备NH3,NH3被碱石灰干燥后进入C装置,E装置生成的NO2经无水CaCl2干燥后也进入C装置,由于NO2具有氧化性,NH3具有还原性,故在C装置中发生反应:6NO2+8NH3=7N2+12H2O2,随着红棕色的NO2被消耗,C装置中气体的颜色逐渐变浅;所以若NO2能够被NH3还原,预期观察到C装置中的现象是C装置中混合气体颜色变浅;
(3)由于多余的NH3、NO2会从C装置中竖直的玻璃导管中逸出,污染环境,所以缺陷是缺少尾气吸收装置;
(4)根据价态分析,NO2中氮元素处于中间价态,既有氧化性又有还原性,Na2O2中的氧元素也处于中间价态,既有氧化性又有还原性,所以假设3应是NO2能被Na2O2还原;
(5)①选择E装置制备NO2,选择D装置干燥NO2,选择B装置盛放Na2O2,选择F装置进行尾气处理,为防止F装置中蒸发出的少量水蒸气对B装置中的反应产生干扰,最好在B、F装置间再加D装置,故装置连接顺序为EDBDF;
②假设2是NO2能被Na2O2氧化,根据B装置产生的实验现象“淡黄色粉末逐渐变成白色”可知Na2O2与NO2发生了反应,NO2为还原剂,分子中氮元素的化合价升高到+5价,反应产物又只有一种,因此推知发生的反应为2NO2+Na2O2=2NaNO3。


科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL 0.200 0 mol/LNH4Cl溶液中逐滴加入0.2000 mol/LNaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
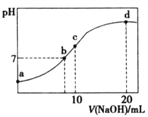
A. a点溶液中:c(H+)+c(NH3·H2O)=c(OH-)+c(NH4+)
B. b点溶液中:c(Cl-)=c(Na+)>c(H+)=c(OH-)
C. c点溶液中:c(NH3·H2O)+ c(NH4+)= c(Cl-)+ c(OH-)
D. d点溶液中:c(Cl-)> c(NH3·H2O)> c(OH-)> c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下表:
实验步骤 | 实验结论 |
①新制氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
②NaBr溶液+新制氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
③KI溶液+新制氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
请回答下列问题:
(1)完成该实验需用到的实验仪器是 、 。(填仪器名称)
(2)步骤②中反应的化学方程式为 ,步骤③中反应的离子方程式为 。
(3)CCl4在实验中所起的作用是 。
(4)该同学的实验设计不足之处是 ,改进的办法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是人们最近提出的一个新概念,主要内容之一是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用。下列化学反应符合绿色化学概念的是( )
A.制CuSO4:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
B.制CuSO4:2Cu+O2![]() 2CuO;CuO+H2SO4(稀)===CuSO4+H2O
2CuO;CuO+H2SO4(稀)===CuSO4+H2O
C.制Cu(NO3)2:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
D.制Cu(NO3)2:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二氧化硫能够与一些卤素单质发生反应生成强酸。某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2) 中的SO2的含量。
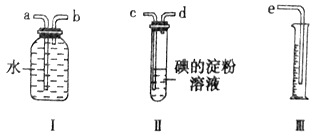
(1)若原料气以左向右流向时,上述装置组装连接的顺序是:原料气→____________(填a、b、c、d、e)。
(2)写出装置Ⅱ中发生反应的离子方程式_____________________ ;当装置Ⅱ中出现___________________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05mol/L、体积为20mL,收集到的N2与O2的体积为297.6 mL(己折算为标准状况下的体积),SO2的体积分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、Cl2是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂。已知K2FeO4在Fe3+和Fe(OH)3催化下会分解,在酸性或弱碱性能与水反应生成Fe(OH)3和O2。生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O
(1)该反应中氧化剂是______________(写电子式)
(2)制备K2FeO4时,将90%的Fe(NO3)3溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是_____________________(回答一条即可)。
(3)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解3.00g K2FeO4样品,调节pH值使高铁酸根全部被还原成铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,滴定终点时,消耗Na2S2O3标准溶液18.00mL。
①滴定终点的现象是__________________________________________。
②原样品中高铁酸钾的质量分数为______________。
II、研究发现,NOx和SO2是雾霾的主要成分。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/moL ①
C(s)+O2(g)=CO2(g) △H=–393.5kJ/moL ②
2C(s)+O2(g)=2CO(g) △H=–221.0kJ/moL ③
(4)某反应的平衡常数表达式![]() ,请写出此反应的热化学方程式:__。
,请写出此反应的热化学方程式:__。
(5)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是___________(填序号)
a.容器中的压强不变
b.2v正(CO)= v逆(N2)
c.气体的平均相对分子质量保持34.2不变
d.该分应平衡常数保持不变
e.NO和CO的体积比保持不变
(6)2SO3(g) ![]() 2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
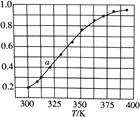
图中a点对应温度下,已知SO3的起始压强为P0kPa,该温度下反应的平衡常数KP=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中按![]() =1加入SO2和SO3,平衡将___________(填“向正反应方向移动”,“向逆反应方向移动”,“不移动”)。
=1加入SO2和SO3,平衡将___________(填“向正反应方向移动”,“向逆反应方向移动”,“不移动”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com