
| A. | 恒容充入N2 | B. | 缩小体积使压强增大 | ||
| C. | 恒容充入氦气 | D. | 恒压充入氦气 |
科目:高中化学 来源: 题型:选择题
| A. | 春节期间燃放的焰火的颜色是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 | |
| C. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外电子层数越多的微粒半径一定较大 | |
| B. | 由5R-+RO-+6H+=3R+3H2O 判断,R元素可能是第ⅤA族元素 | |
| C. | 元素周期表对于生产和科研具有重要的指导意义,如半导体材料通常位于过渡元素区 | |
| D. | 既有非金属元素简单阴离子,又有非金属元素简单阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
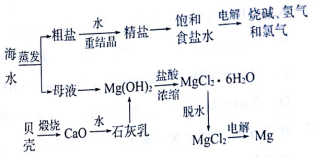
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | 原子半径大小为W>Z>Y>X | |
| B. | W的最高价含氧酸的酸性最强 | |
| C. | X、Z、Y、W的最髙正价分别为+4、+5、+6、+7 | |
| D. | Z与W形成的所有化合物中.原子最外层电子均达到8e-稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 | |
| B. | 微粒半径:K+>Al3+>S2->Cl- | |
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | |
| D. | 金属性:K>Ca>Mg>Be |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最常见的氢化物的沸点:Y>X>W>Z | |
| B. | 简单离子半径:W>X>Y>Z | |
| C. | Y与Z能形成化学键类型完全相同的两种化合物 | |
| D. | Z与W形成的常见化合物溶于水后,水的电离程度变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
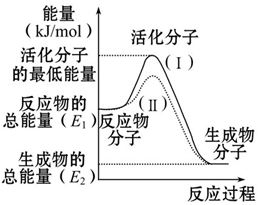 请认真观察如图,然后回答问题:
请认真观察如图,然后回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com