
| A. | 过氧化钠是淡黄色固体,久置于空气中变成白色的氢氧化钠固体 | |
| B. | 过氧化钠中阴阳离子比例为1:2 | |
| C. | 用过氧化钠漂白织物、麦秆等日久又逐渐变成黄色 | |
| D. | Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 |
分析 A.生成的氢氧化钠会与空气中二氧化碳反应生成碳酸钠;
B.过氧化钠中阴离子为过氧根离子,阳离子为钠离子;
C.过氧化钠的漂白为永久的,不会褪色;
D.过氧化钠与水反应生成碱和氧气,而碱性氧化物与水反应生成的只有碱.
解答 解:A.Na2O2是淡黄色固体,易与空气中水、二氧化碳反应,最终生成Na2CO3白色固体,故A错误;
B.Na2O2中阴离子为过氧根离子,阳离子为钠离子,过氧根离子与钠离子数之比为1:2,故B正确;
C.过氧化钠具有强氧化性,能够漂白有色物质,且漂白性为永久的,用过氧化钠漂白织物、麦秆等日久也不会褪色,故C错误;
D.Na2O与酸反应生成盐和水,氧化钠为碱性氧化物,过氧化钠与酸反应生成盐和水外,还生成了氧气,过氧化钠不属于碱性氧化物,故D错误;
故选B.
点评 本题考查了钠的化合物,题目难度不大,侧重考查钠及其化合物性质,明确常见元素及其化合物性质为解答关键,D为易错点,注意过氧化钠不属于碱性氧化物,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | a为电池的负极 | |
| B. | 电池充电时a极反应为:Li1-xMn2O4+xe-+xLi+═LiMn2O4 | |
| C. | 充电时,a极锂的化合价发生变化 | |
| D. | 放电时,溶液中SO42-从a向b迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体.根据你所学的知识回答下列问题:
蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体.根据你所学的知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去溴苯中的溴:加入CCl4后分液 | |
| B. | 除去乙醇中的乙酸:加入NaOH溶液后分液 | |
| C. | 除去乙烷中的乙烯:加入氢气后在一定条件下充分反应 | |
| D. | 除去苯甲醛中的苯甲酸:加入生石灰后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸硫酸 H2SO3 | B. | 酸性氧化物干冰 CO | ||
| C. | 碱性氧化物氧化钙 CaO | D. | 盐苏打 NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
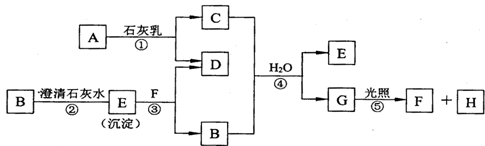
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75:2);②在碳存在下,X与N2反应生成AlN.请回答:
氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75:2);②在碳存在下,X与N2反应生成AlN.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是M、N两种不含结晶水的固体物质溶解度曲线.下列说法中正确的是( )
如图是M、N两种不含结晶水的固体物质溶解度曲线.下列说法中正确的是( )| A. | t1℃时,N比M的溶解度大 | |
| B. | 温度从t1℃升高到t3℃时,N的饱和溶液张溶质的质量分数将增大 | |
| C. | M比N的溶解度大 | |
| D. | N中含有少量M时,可用降温结晶法提纯N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com