

分析 (1)①2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H1
②H2O(l)?H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
根据盖斯定律,方程式①-3×②-2×③得到方程2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l),据此计算△H;
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)①由图1可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动;
②平衡常数与浓度、压强无关,只与温度有关,结合平衡移动判断;增大压强平衡正移,CO的转化率增大;
③A、B两点温度相等,压强不同,平衡常数相同,利用三段式计算A、B两点平衡时各组分物质的量,根据A点各物质的浓度计算平衡常数,再根据平衡常数计算B点体积;
(4)①由图可知,在4.0×106Pa时转化率相对比较大,再增大压强,转化率增大不多,会对设备要求较大;
②由图可知,高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低.
解答 解:(1)已知:①2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H1
②H2O(1)═H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
根据盖斯定律,则①-②×3-③×2得2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O,则:△H=△H1-3△H2-2△H3,
故答案为:H=△H1-3△H2-2△H3;
(2)a.v(H2)正=2v(CO)逆与化学计量数对应成比例,能说明达到平衡,故a正确;
b.平衡常数与浓度、压强无关,只与温度有关,温度一定时平衡常数为定值,绝热密闭容器中,容器中的温度随着反应进行不断变化,则平衡常数不断变化,当平衡常数不变时说明达到了平衡状态,故b正确;
c.容器体积不变,混合气体总质量不变,混合气体密度始终保持不变,不能说明得到平衡,故c错误;
d.随着反应的进行,CH3OCH3和H2O的体积之比始终不随时间而变化,无法说明反应到达平衡,故d错误,
故答案为:a、b;
(3)①由图1可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,即正反应为放热反应,故答案为:放热;
②平衡常数与压强无关,只与温度有关,A、B温度相等,则KA=KB,相同压强下,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,则平衡常数减小,故KB>KC,故KA=KB>KC;增大压强平衡正移,CO的转化率增大,已知P2条件下,CO的转化率大,则P1<P2;
故答案为:KA=KB>KC; P1<P2;
③A、B两点温度相等,压强不同,平衡常数相同,
对应A点,CO转化率为0.5,参加反应CO为10mol×0.5=5mol,
CO(g)+2H2(g)?CH3OH(g)
开始(mol):10 20 0
转化(mol):5 10 5
平衡(mol):5 10 5
故T1温度下,平衡常数K=$\frac{\frac{5}{10}}{\frac{5}{10}×(\frac{10}{10})^{2}}$=1
对应B点,CO转化率为0.8,参加反应CO为10mol×0.8=8mol,
CO(g)+2H2(g)?CH3OH(g)
开始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设平衡时的体积为VL,则$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V})^{2}}$=1,解得V=2
故答案为:2;
(4)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率变化最大的是34.0×106Pa,再增大压强,转化率增大不多,会对设备要求较大,因选择压强:4.0×106Pa,
故答案为:4.0×106Pa;
②由图可知,温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,甲醇转化率会降低,
故答案为:高于80℃时,温度对反应速率影响较小,且反应放热,升高温度时平衡逆向移动,转化率降低.
点评 本题考查化学平衡常数有关计算、化学平衡图象及影响因素、化学平衡状态判断、反应热计算,注意掌握化学平衡常数的应用,掌握三段式计算方法,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | X的气态氢化物的热稳定性比O(氧)的强 | |
| B. | 元素Z、W的简单离子具有相同的电子层结构 | |
| C. | Y、Z、W的最高价氧化物对应的水化物之间能相互反应 | |
| D. | 等质量的Y和Z单质分别与足量稀盐酸反应,前者产生的氢气多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )
2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )| A. | 都是电解质 | B. | 都易溶于水 | ||
| C. | 都能与碱溶液反应 | D. | 都属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在配制一定物质的量浓度溶液的实验中量筒是必需仪器 | |
| B. | 实验室中,盛装NaOH 溶液的试剂瓶用橡皮塞 | |
| C. | 某未知液中加入稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+ | |
| D. | 用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH 试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
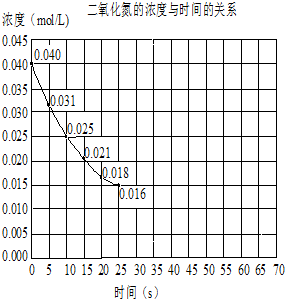
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | 200 | 300 | 400 | 500 |
| K | 5×108 | 1.0 | 0.86 | 0.507 | 0.152 |
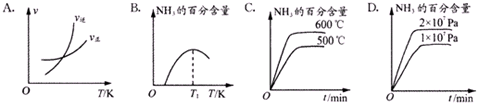
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
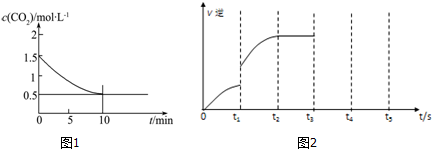
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③⑤⑨ | C. | ④⑤⑥⑦ | D. | ②③⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28gMgCO3和NaHCO3混合固体中的CO32-离子数为NA | |
| B. | lmolI2与4molH2反应生成的HI分子数为2NA | |
| C. | 1molAl溶于含1molNaOH溶液,电子转移数为3NA | |
| D. | 标准状况下,2.24LH2O含有的共价键数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com