
【题目】反应N2+O2![]() 2NO在恒容密闭容器中进行,达到平衡后,充入N2,下列说法正确的是
2NO在恒容密闭容器中进行,达到平衡后,充入N2,下列说法正确的是
A. 平衡向逆反应方向移动,N2和O2的转化率都减小
B. 平衡向正反应方向移动,N2和O2的转化率都增大
C. 压强增大平衡不移动,N2的转化率不变
D. 平衡向正反应方向移动,N2的转化率减小,O2的转化率增大
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
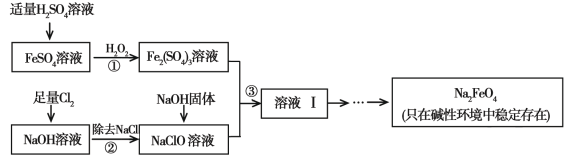
(1)高铁酸钠中铁元素的化合价为 ,次氯酸钠的电子式是________。
(2)步骤①反应的离子方程式是 。
(3)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离子方程式为 。
(4)工业上还可用电解浓NaOH溶液的方法制Na2FeO4,其工作原理如图所示:
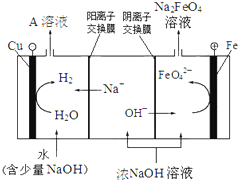
阳极的电极反应式为 。可循环使用的物质是 。
(5)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的________倍,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:下列两个热化学方程式: Fe(s) + 1/2O2(g) ![]() FeO(s)
FeO(s) ![]() =-272.0KJ/mol,2Al(s) + 3/2O2(g)
=-272.0KJ/mol,2Al(s) + 3/2O2(g) ![]() Al2O3(s)
Al2O3(s) ![]() =-1675.7KJ/mol 则 Al(s)的单质和FeO(s)反应的热化学方程式是____________________________。
=-1675.7KJ/mol 则 Al(s)的单质和FeO(s)反应的热化学方程式是____________________________。
(2)对于下列反应:2SO2 + O2 ![]() 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L· min),那么2min时SO2的浓度为 。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L· min),那么2min时SO2的浓度为 。
(3)如图表示在密闭容器中反应:2SO2+O2![]() 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;
(4)若增大压强时,将反应速度变化情况画在c—d处

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是温度和压强对反应:X+Y ![]() 2Z 影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z 影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
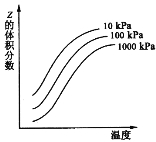
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y只有一种为气态,Z为气态
D.上述反应的逆反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017 年世界地球日我国的主题为“节约集约利用资源,倡导绿色简约生活”。下列做法应提倡的是
A.夏天设定空调温度尽可能的低
B.推广使用一次性塑料袋和纸巾
C.少开私家车多乘公共交通工具
D.对商品进行豪华包装促进销售
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述均正确且Ⅰ、Ⅱ两者间有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 工业合成氨的反应在高温下进行 | N2+3H2 |
B | 明矾水溶液水解生成胶体 | 明矾可用于净水 |
C | SiO2是酸性氧化物 | HF溶液不能用玻璃试剂瓶盛放 |
D | 氯的非金属性比碘强 | 酸性:氢碘酸强于盐酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | NaOH | H2SO4 | BaCO3 | Al2O3 | CO2 |
B | KOH | HCl | NaCl | Na2O | CO |
C | NaOH | H2SO3 | CaCl2 | CuO | SO2 |
D | Na2CO3 | HNO3 | CaCO3 | MgO | SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.阿伏加德罗常数个硫酸分子里含有4molO B.CH4的摩尔质量为16g
C.lmolFe的质量为56g/mol D.lmolNH3为18克
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com