
【题目】请按要求回答下列问题:
(1)醇的官能团的名称是_____。
(2)某气态有机物相对于氢气的密度为14,则其结构简式为_____。
(3)某有机物的结构简式如图所示,则其一氯代物共有_____种。

(4)新戊烷用系统命名法命名应为_____。
(5)分别将等物质的量的C3H8、C4H8完全燃烧,消耗氧气质量多的是_____(填分子式)。
(6)下列最简式中,只能代表一种有机物的有_____(选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
【答案】羟基 CH2=CH2 2 2,2-二甲基丙烷 C4H8 ①④
【解析】
⑴醇的官能团—OH得名称。
⑵先计算摩尔质量,再得到分子式和结构简式。
⑶该物质有两条对称轴,有2种位置的氢。
⑷新戊烷 用系统命名法命名。
用系统命名法命名。
⑸根据CxHy~![]() O2,1mol C3H8完全燃烧消耗5mol O2,1mol C4H8完全燃烧消耗6mol O2。
O2,1mol C3H8完全燃烧消耗5mol O2,1mol C4H8完全燃烧消耗6mol O2。
⑹①CH3只是乙烷的最简式,只代表一种有机物;②CH2是烯烃的最简式或环烷烃的最简式,不只代表一种有机物;③CH2O是甲醛的最简式或乙酸的最简式,不只代表一种有机物;④CH4O是甲醇的最简式,只代表一种有机物。
⑴醇的官能团的名称是羟基。
⑵某气态有机物相对于氢气的密度为14,![]() ,M=28 gmol1,根据28÷12 =24得到分子式为C2H4,该有机物是烯烃,则其结构简式为CH2=CH2;故答案为:CH2=CH2。
,M=28 gmol1,根据28÷12 =24得到分子式为C2H4,该有机物是烯烃,则其结构简式为CH2=CH2;故答案为:CH2=CH2。
⑶某有机物的结构简式如图所示,该物质有两条对称轴,有2种位置的氢,因此其一氯代物共有2种;故答案为:2。
⑷新戊烷 用系统命名法命名应为2,2-二甲基丙烷;故答案为:2,2-二甲基丙烷。
用系统命名法命名应为2,2-二甲基丙烷;故答案为:2,2-二甲基丙烷。
⑸根据CxHy~![]() O2,1mol C3H8完全燃烧消耗5mol O2,1mol C4H8完全燃烧消耗6mol O2,因此等物质的量的C3H8、C4H8完全燃烧消耗氧气质量多的是C4H8;故答案为:C4H8。
O2,1mol C3H8完全燃烧消耗5mol O2,1mol C4H8完全燃烧消耗6mol O2,因此等物质的量的C3H8、C4H8完全燃烧消耗氧气质量多的是C4H8;故答案为:C4H8。
⑹①CH3只是乙烷的最简式,只代表一种有机物,故①符合题意;②CH2是烯烃的最简式或环烷烃的最简式,不只代表一种有机物,故②符合题意;③CH2O是甲醛的最简式或乙酸的最简式,不只代表一种有机物,故③符合题意;④CH4O是甲醇的最简式,只代表一种有机物,故④符合题意;综上所述,答案为:①④。


科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是干电池的生产和消费大国。某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:

已知:经过反应Ⅰ后,所有金属元素均以离子形式存在。
回答下列问题:
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,请写出电池的正极反应式__________。
(2)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应化学方程式________________。
(3)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,请写出该反应的离子方程式______。
(4)反应Ⅲ中X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”)。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某食用香料乙酸橙花酯的结构简式如图所示,则关于该有机物叙述中正确的个数是( )

①分子式为C12H20O2 ②它的同分异构体中有芳香族化合物 ③能使酸性KMnO4溶液褪色 ④1mol该有机物在一定条件下能和3mol H2反应 ⑤密度比水小 ⑥1mol该有机物水解时能消耗1molNaOH⑦能在一定条件下生成高分子化合物
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
C | 室温下分别测定NaClO溶液、CH3COONa溶液的pH | 前者大 | 酸性:HClO>CH3COOH |
D | NaHCO3溶液中滴入酚酞 | 溶液变红 | 弱酸的酸式盐溶液均呈碱性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂、显影液等。某化学兴趣小组对(NH4 )2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+ H2O 2CrO42-(黄色)+ 2H+。请回答下列问题:
(1)取少量(NH4)2Cr2O7浓溶液于试管中,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是______________。
(2)为探究(NH4)2Cr2O7 (摩尔质量为252 g/mol)加热的分解产物,按下图连接好仪器,加热装置略去,在A中加入5.040 g样品进行实验。
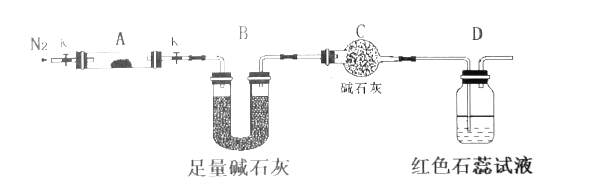
①仪器A的名称是______________。
②连接好装置,点燃酒精灯之前,先通入一段时间N2其目的为___________。
③反应结束后,依然要通一段时间的氮气的原因是________________________。
④加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为Cr2O3、B中质量的变化为1.44 g,写出重铬酸铵加热分解反应的化学方程式:____________________。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数(杂质不发生反应),其反应原理为 2Ba2++Cr2O72- + H2O = 2BaCrO 4↓+2H+、4NH4++6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mo1 (CH2)6N4H+ 与 1 mo1 H+ 相当],然后用 NaOH 标准溶液滴定反应生成的酸。
实验步骤:称取样品5.600 g,配成500 mL溶液,移取25.00 mL样品溶液于 250 mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10 mL 20.00 mol·L-1的中性甲醛溶液,摇匀、静置5 min后,加入12滴酚酞试液,用0.200 mo1 L-1 NaOH 标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为16.00 mL。
①若滴定终点时,俯视读数,则测定结果_____(填“偏大” “偏小”或“无影响”)。
②滴定计算得该样品中氮的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学知识在物质制备领域的应用前景看好。

(1)从环境保护的角度看,制备一种新型多功能水处理剂 高铁酸钠(Na2FeO4)较好的方法为电解法,其装置如图①所示:
①电解过程中阳极的电极反应式为______________________;
②“镁一次氯酸盐”燃料电池可为图①装置提供电能,该电池电极为镁合金和铂合金,其工作原理如图②所示。b为该燃料电池的___________(填“正"或“负")极。当有16.6 g Na2FeO4生成时消耗C1O-的物质的量为______mol;
(2)电解Na2SO4溶液生产H2SO4和烧碱的装置如图③所示(已知:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过),其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2。则丁为_________;电解一段时间,当产生0.1 mo1气体甲时,通过离子交换膜f的离子的质量为_____________g。
(3)用0.1032 mol/L的NaOH溶液滴定未知浓度的稀盐酸,实验数据如下表:
实验序号 | 消耗NaOH溶液的体积/mL | 待测稀盐酸的体积/mL |
1 | 28.84 | 25.00 |
2 | 27.83 | 25.00 |
3 | 27.85 | 25.00 |
根据表格计算c(HCl)=______________。在上述滴定过程中,若滴定前碱式滴定管下端尖嘴中无气泡,滴定后有气泡,则测定结果将__________ (填“偏大”、“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,VIA元素单质与H2反应生成气态H2X的热化学方程式如下:
1/2O2(g) + H2(g) =H2O(g) ΔH = -242 kJ·mol-1
S(g) + H2(g) =H2S(g) ΔH = -20 kJ·mol-1
Se(g) + H2(g)![]() H2Se(g) ΔH = +81 kJ·mol-1
H2Se(g) ΔH = +81 kJ·mol-1
下列说法正确的是( )
A. 稳定性:H2O > H2S > H2Se
B. 降温有利于Se与H2反应生成H2Se
C. O2(g) + 2H2S(g)=2H2O(g) + 2S(g) ΔH = 444 kJ·mol-1
D. 随着核电荷数的增加,VIA族元素单质与H2的化合反应越容易发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-=![]() +4H2O
+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com