
【题目】将3 mol O2加入V L的反应器中,在高温下放电,经t1 s 建立了平衡体系:3O2![]() 2O3,此时测知O2的转化率为30%,下列图像能正确表示气体的物质的量(n)跟时间(t)的关系的是
2O3,此时测知O2的转化率为30%,下列图像能正确表示气体的物质的量(n)跟时间(t)的关系的是
A. B.
B. C.
C. D.
D.
【答案】C
【解析】
根据O2的转化率利用三段式计算平衡时各组分的浓度,
3O2![]() 2O3
2O3
n(始):3 0
n(变):0.9 0.6
n(平):2.1 0.6
O2的起始浓度为3mol/VL,O2的平衡浓度为2.1mol/VL,O3的起始浓度为0,O3的平衡浓度为0.6mol/VL,O2的物质的量大于O3的物质的量。O2为反应物,随着反应的进行浓度逐渐减小;O3为生成物,随着反应的进行浓度逐渐增大.达到平衡时n(O2)=2.1 mol>n(O3)=0.6 mol。
A、图象表示O2和O3的物质的量一直在变,没有平衡的特征,与实际不符,故A错误;
B、图象表示平衡时O2和O3的物质的量相同,与实际不符,故B错误;
C、图象表示平衡时O2的物质的量大于O3的物质的量,与实际相符,故C正确;
D、图象表示平衡时O2的物质的量小于O3的物质的量,与实际不符,故D错误。
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室制取蒸馏水如图所示:
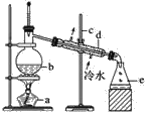
请回答下列问题:
(1)仪器b的名称是___,仪器d的名称是___。
(2)蒸馏水收集在仪器____中。
(3)仪器d的作用是___,冷水进入d仪器的方向如图所示,不能改为“上进下出”的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述不正确的是( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1nm100nm之间
B.用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分
C.把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体
D.树林中的晨曦,该现象与丁达尔效应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在指定条件下,下列各组离子一定能大量共存的是
A.滴加甲基橙显红色的溶液中:Na+、Fe2+、C1-、NO![]()
B.0.1mol·L-1FeC13溶液中:NH![]() 、Mg2+、SO
、Mg2+、SO![]() 、NO
、NO![]()
C.0.1mo1·L-1KI溶液中:Na+、K+、ClO-、OH-
D.由水电离的c(H+)=1.0×10-13 mo1·L-1的溶液中:K+、NH![]() 、C1-、HCO
、C1-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
时间/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol·L-1 | 5.00 | 3.50 | 2.50 | 2.50 |
A. 500 s内NO2的生成速率为3.00×10-3 mol·L-1·s-1
B. T1温度下该反应平衡时N2O5的转化率为50%
C. 达平衡后其他条件不变,将容器体积压缩到原来的![]() ,c(N2O5)<5.00 mol·L-1
,c(N2O5)<5.00 mol·L-1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g)pC(g)+qD(g)已知:平均反应速率v(C)=![]() v(A);反应2 min时,A的浓度减少了
v(A);反应2 min时,A的浓度减少了![]() a mol,B的物质的量减少了
a mol,B的物质的量减少了![]() mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,v(A)=________,v(B)=________。
(2)化学方程式中,x=________,y=________,p=________,q=________。
(3)反应平衡时,D为2a mol,则B的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、F、Cu及其化合物在化工、医药、材料等方面应用十分广泛。回答下列有关问题:
(1)N原子中最高能级的电子的电子云轮廓图为___________;基态Cu+的核外电子排布式为____________。
(2)化合物(CH3)3N可用于制备医药、农药。分子中N原子杂化方式为________,该物质能溶于水的原因是_____________________。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,其阳离子的空间构型为_____________,写出一种与[H2F]+互为等电子体的分子______________(写化学式)。
(4)氮、铜形成的一种化合物的晶胞结构如图所示。与每个Cu原子紧邻的Cu原子有____个,令阿伏加德罗常数的值为NA,该晶体的密度为______g/cm3。(列出计算式)
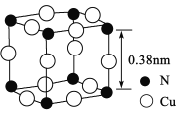
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
(1)向两支试管中分别加入3 mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应初始时观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。
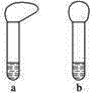
(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如上图所示,则试管b中反应的离子方程式为___________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ·mol-1,

下列说法或表示式正确的是
A. 石墨和金刚石的转化是物理变化
B. C(s、石墨)===C(s、金刚石)ΔH =+1.9kJ·mol-1
C. 金刚石的稳定性强于石墨
D. 断裂1mol石墨的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com