
| A、1mol.L-1氢氯酸(HCN)的pH约为3 |
| B、常温下,pH=4的氢氯酸稀释100倍后所得溶液pH<6 |
| C、10mL 1 mol.L-1氢氯酸(HCN)恰好与10mL 1 mol.L-1NaOH溶液完全反应 |
| D、常温下,0.1mol.L-1NaCN溶液的pH约为10 |


科目:高中化学 来源: 题型:
| A、用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| B、酸碱中和滴定时用待测液润洗锥形瓶,所测结果偏高 |
| C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D、测定中和反应的反应热时,将碱缓慢倒入酸中,所测最高温度值偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种溶液pH的大小顺序:①>④>③>② |
| B、溶液①、②等体积混合后pH>7,则c(NH4+)<c(NH3?H2O) |
| C、向溶液①、②中分别加入25 mL 0.1mol/L 盐酸后,溶液中c(NH4+):①>② |
| D、向溶液③、④中分别加入25mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
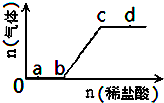 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列粒子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列粒子组在对应的溶液中一定能大量共存的是( )| A、a点对应的溶液中:Na+、SO42-、NO3-、Fe(OH)3胶体微粒 |
| B、b点对应的溶液中:Al3+、H+、MnO4-、Cl- |
| C、c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
| D、d点对应的溶液中:F-、NO3-、Fe2+、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+ | ||
| B、Fe2+ | ||
| C、Al3+ | ||
D、N
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅单质可用于光纤通讯 |
| B、由SiO2制取硅酸,可先使SiO2与NaOH溶液反应,再通入CO2 |
| C、青石棉[Na2Fe5Si8O22(OH)2]的化学组成可表示为:Na2O?3FeO?Fe2O3?8SiO2?H2O |
| D、Na2SiO3可用于制备木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
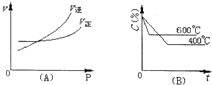 如图中C%表示某反应物在体系中的百分含量,图(A)为温度一定时压强与反应速度的关系曲线.图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,图(A)为温度一定时压强与反应速度的关系曲线.图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )| A、N2O3(g)?NO2(g)+NO(g)△H>0 |
| B、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 |
| C、3NO2(g)+H2O(I)?2HNO3(I)+NO(g)△H<0 |
| D、CO2(g)+C(s)?2CO(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
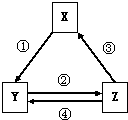 下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | Na2O2 | NaOH | NaCl | ①常温遇水 |
| B | Al2O3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
| C | NO | NO2 | HNO3 | ④加入铜粉 |
| D | Cl2 | NaClO | HClO | ③加浓盐酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com