
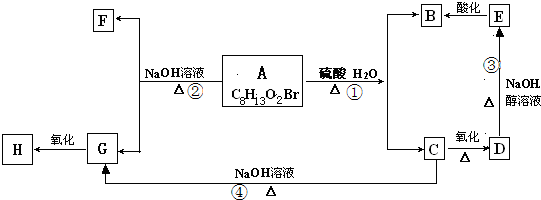
分析 A的分子式为C8H13O2Br,A在氢氧化钠水溶液、浓硫酸作用下发生反应,结合转化关系可知故A含有酯基,A的不饱和度为$\frac{2×8+2-13-1}{2}$=2,故A分子中还含有C=C双键,C连续氧化生成D,故C含有-OH,D中含有-COOH,D在氢氧化钠醇溶液、加热条件下生成E,E酸化生成B,故C中含有-Br,且B、C含有相同的碳原子数目为4,碳链类似,C在氢氧化钠水溶液中发生水解反应生成G,F含有2个-OH,G连续氧化生成H,5.9g物质H能与1mol/LNaOH的溶液100mL恰好完全反应,说明H中含有羧基,0.1mol物质H与足量金属钠反应在标准状况下生成2.24L氢气,氢气的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,故H中含有1个-COOH、1个-OH或含有2个-COOH,若H中含有1个-COOH、1个-OH,则5.9g物质H的物质的量为1mol/L×0.1L=0.1mol,则物质H的相对分子质量为$\frac{5.9}{0.1}$=59,不合题意,故H中不可能含有1个-COOH、1个-OH,故H中含有2个-COOH,H的分子结构中含有一个甲基,所以H为HOOC-C(CH3)-COOH,结合转化关系可知,
G为HOCH2-CH(CH3)-CH2OH,C为BrCH2-CH(CH3)-CH2OH,D为BrCH2-CH(CH3)-COOH,E为CH2=C(CH3)-COONa,B为CH2=C(CH3)-COOH,A为CH2=C(CH3)-COOCH2-CH(CH3)-CH2Br,F为CH2=C(CH3)-COONa,以此解答该题.
解答 解:A的分子式为C8H13O2Br,A在氢氧化钠水溶液、浓硫酸作用下发生反应,结合转化关系可知故A含有酯基,A的不饱和度为$\frac{2×8+2-13-1}{2}$=2,故A分子中还含有C=C双键,C连续氧化生成D,故C含有-OH,D中含有-COOH,D在氢氧化钠醇溶液、加热条件下生成E,E酸化生成B,故C中含有-Br,且B、C含有相同的碳原子数目为4,碳链类似,C在氢氧化钠水溶液中发生水解反应生成G,F含有2个-OH,G连续氧化生成H,5.9g物质H能与1mol/LNaOH的溶液100mL恰好完全反应,说明H中含有羧基,0.1mol物质H与足量金属钠反应在标准状况下生成2.24L氢气,氢气的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,故H中含有1个-COOH、1个-OH或含有2个-COOH,若H中含有1个-COOH、1个-OH,则5.9g物质H的物质的量为1mol/L×0.1L=0.1mol,则物质H的相对分子质量为$\frac{5.9}{0.1}$=59,不合题意,故H中不可能含有1个-COOH、1个-OH,故H中含有2个-COOH,H的分子结构中含有一个甲基,所以H为HOOC-C(CH3)-COOH,结合转化关系可知,
G为HOCH2-CH(CH3)-CH2OH,C为BrCH2-CH(CH3)-CH2OH,D为BrCH2-CH(CH3)-COOH,E为CH2=C(CH3)-COONa,B为CH2=C(CH3)-COOH,A为CH2=C(CH3)-COOCH2-CH(CH3)-CH2Br,F为CH2=C(CH3)-COONa,
(1)由以上分析可知H为HOOC-C(CH3)-COOH,E为CH2=C(CH3)-COONa,故答案为:HOOC-C(CH3)-COOH;CH2=C(CH3)-COONa;
(2)C为BrCH2-CH(CH3)-CH2OH,在氢氧化钠水溶液中发生取代反应生成HOCH2-CH(CH3)-CH2OH,D为BrCH2-CH(CH3)-COOH,发生消去反应生成CH2=C(CH3)-COONa,
故答案为:取代反应;消去反应;
(3)D→E是BrCH2-CH(CH3)-COOH在氢氧化钠醇溶液、加热条件下,发生消去反应与中和反应生成CH2=C(CH3)-COONa,反应方程式为:BrCH2-CH(CH3)-COOH+2NaOH$→_{△}^{乙醇}$CH2=C(CH3)-COONa+NaBr+2H2O,
故答案为:BrCH2-CH(CH3)-COOH+2NaOH$→_{△}^{乙醇}$CH2=C(CH3)-COONa+NaBr+2H2O;
(4)A为CH2=C(CH3)-COOCH2-CH(CH3)-CH2Br,E为CH2=C(CH3)-COONa,A在碱性条件下发生水解反应生成E,反应的方程式为CH2=C(CH3)-COOCH2-CH(CH3)-CH2Br+2NaOH$→_{△}^{水}$CH2=C(CH3)-COONa+HOCH2-CH(CH3)-CH2OH+NaBr,
故答案为:CH2=C(CH3)-COOCH2-CH(CH3)-CH2Br+2NaOH$→_{△}^{水}$CH2=C(CH3)-COONa+HOCH2-CH(CH3)-CH2OH+NaBr;
(5)由以上分析可知E、F属于同一物质,故答案为:E和F;
(6)H为HOOC-C(CH3)-COOH,属于二元酯类的同分异构体有CH3COOCH2OOCH、HCOOCH(CH3)OOCH、HCOOCH2CH2OOCH,
故答案为:CH3COOCH2OOCH、HCOOCH(CH3)OOCH、HCOOCH2CH2OOCH.
点评 本题考查有机物的推断,为高考常见题型,难度较大,是对有机物知识的综合运用及学生思维能力的考查,根据转化关系并结合A的分子式,判断A含有官能团,进而推断各物质含有的官能团,根据H的与氢氧化钠及与钠反应,推断H的结构是解题的关键.


科目:高中化学 来源: 题型:填空题
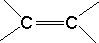 )中的π键不能自由旋转,因此CH3CH=CHCH3有两种顺反异构体.苏丹红Ⅰ号的分子结构如图1所示,分子中所有原子有(填“有”或“不”)可能在同一平面上.它的另一顺反异构体的结构简式为
)中的π键不能自由旋转,因此CH3CH=CHCH3有两种顺反异构体.苏丹红Ⅰ号的分子结构如图1所示,分子中所有原子有(填“有”或“不”)可能在同一平面上.它的另一顺反异构体的结构简式为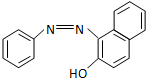 .苏丹红Ⅰ号在水中的溶解度很小,微溶于乙醇,若把羟基取代在对位形成图2所示结构,则其溶解度会增大,熔点升高(填“升高”或“降低”).下面两种物质的物理性质存在上述差异的原因可能是苏丹红I号形成分子内氢键,而修饰后的分子形成分子间氢键,分子间氢键有利于增加分子间作用力,从而有利于增大化合物的溶解度和提高熔点.
.苏丹红Ⅰ号在水中的溶解度很小,微溶于乙醇,若把羟基取代在对位形成图2所示结构,则其溶解度会增大,熔点升高(填“升高”或“降低”).下面两种物质的物理性质存在上述差异的原因可能是苏丹红I号形成分子内氢键,而修饰后的分子形成分子间氢键,分子间氢键有利于增加分子间作用力,从而有利于增大化合物的溶解度和提高熔点.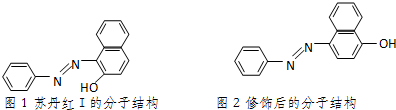
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
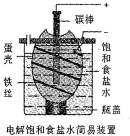 某化学课外学习小组设计电解饱和食盐水的简易装置如图(蛋壳内及壳外容器均充满饱和食盐水).有关说法正确的是( )
某化学课外学习小组设计电解饱和食盐水的简易装置如图(蛋壳内及壳外容器均充满饱和食盐水).有关说法正确的是( )| A. | 通电一段时间后,往蛋壳内溶液中滴加几滴酚酞,呈红色 | |
| B. | 蛋壳表面缠绕的铁丝发生氧化反应 | |
| C. | 碳棒上产生的气体能使湿润的淀粉碘化钾试纸变蓝 | |
| D. | 电解一段时间后,蛋壳外溶液的pH下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
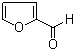 呋喃甲醛(即糠醛)的结构简式如图,其分子中的环和苯环有相似的化学性质(即有“芳香性”),则关于糠醛的叙述错误的是( )
呋喃甲醛(即糠醛)的结构简式如图,其分子中的环和苯环有相似的化学性质(即有“芳香性”),则关于糠醛的叙述错误的是( )| A. | 能生成呋喃甲醇 | B. | 能生成呋喃甲酸 | ||
| C. | 能与溴水生成多种加成产物 | D. | 能与苯酚制备糠醛树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 反应前质量/g | 反应后质量/g | |
| U型管+固体 | a | b |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com