
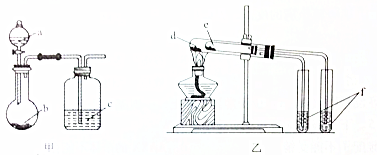
| 选项 | 实验试剂 | 实验结论 | ||
| A | a.稀硫酸 | b.碳酸氢钠 | c.硅酸钠溶液 | 酸性:硫酸>碳酸>硅酸 |
| B | a.稀盐酸 | b.二氧化锰 | c.溴化钠溶液 | 氧化性:MnO2>Cl2>Br2 |
| C | d.小苏打 | e.苏打 | f.石灰水 | 热稳定性:苏打>小苏打 |
| D | d.氯化钠 | e.氯化铵 | f.硝酸银溶液 | 沸点:氯化钠>氯化铵 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.强酸能弱酸盐反应生成弱酸,根据强酸制取弱酸判断酸性强弱;
B.稀盐酸和二氧化锰不反应,浓盐酸和二氧化锰在加热条件下反应生成氯气;
C.碳酸钠热稳定性较强,碳酸氢钠不稳定,受热易分解;
D.氯化铵不稳定受热易分解.
解答 解:A..强酸能弱酸盐反应生成弱酸,根据强酸制取弱酸判断酸性强弱,稀硫酸和碳酸氢钠反应生成二氧化碳,二氧化碳、水和硅酸钠反应生成难溶性硅酸,看到的现象是烧瓶中有气体生成、c中有沉淀生成,所以可以实现实验目的,故A正确;
B.稀盐酸和二氧化锰不反应,浓盐酸和二氧化锰在加热条件下反应生成氯气,所以不能得到氯气,不能实现实验目的,故B错误;
C.碳酸钠热稳定性较强,碳酸氢钠不稳定,受热易分解,所以d为碳酸钠、e为碳酸氢钠,故C错误;
D.氯化铵不稳定受热易分解,所以该装置不能实现实验目的,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及酸性强弱判断、氧化性强弱判断、物质稳定性强弱判断等知识点,明确实验原理及物质性质是解本题关键,题目难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物水化物的碱性:Y<Z | B. | 简单气态氢化物的热稳定性:X<W | ||
| C. | X分别与Z、W形成化合物的熔点:Z<W | D. | 简单离子的还原性:X<W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲的命名主链选择是错误的 | B. | 乙的命名正确 | ||
| C. | 丙的命名主链选择是正确的 | D. | 丁的命名正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1KAl(SO4)2溶液中含0.2NA个SO42- | |
| B. | 常温下,9gH2O含NA个O-H键 | |
| C. | 同温同压同体积的CO2、SO2所含氧原子数均为2NA | |
| D. | 32gCu与S完全反应转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
下列各组数据中,前者刚好是后者两倍的是
A.2 mol水的摩尔质量和1 mol水的摩尔质量
B.20 0 mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 2 mol/L氯化钾溶液中c(Cl-)
0 mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 2 mol/L氯化钾溶液中c(Cl-)
C.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 滴定时,装未知浓度的NaOH溶液锥形瓶忘记用NaOH溶液润洗 | |
| B. | 酸式滴定管用蒸馏水洗后,忘记用盐酸润洗 | |
| C. | 滴定前,滴定管的尖嘴处有气泡,而在滴定后气泡消失 | |
| D. | 滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com