
【题目】瑞香素具有消炎杀菌作用,结构如图所示,下列叙述正确的是
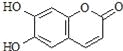
A.与稀H2SO4混合加热不反应
B.不能使酸性高锰酸钾溶液褪色
C.1mol 瑞香素最多能与3mol Br2发生反应
D.1mol瑞香素与足量的NaOH溶液发生反应时,消耗NaOH 3mol
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】镍具有良好的导磁性和可塑性,主要用于制作合金及催化剂。请回答下列问题
(1)基态镍原子的价电子排布图为____,同周期元素中基态原子与镍具有相同未成对电子的还有____种。
(2)四羰基合镍是一种无色挥发性液体,熔点-25℃,沸点43℃。则四羟基合镍中σ键和π键数目之比为___三种组成元素按电负性由大到小的顺序为____。
(3)[Ni(NH3)
4]SO4中N原子的杂化方式为____,写出与SO42-互为等电子体的一种分子和一种离子的化学式____,____;[Ni(
NH3)4]SO4中H-N-H键之间的夹角___(填“>”“<”或“=”)NH3分子中H-N-H键之间的夹角。
(4)已知NiO的晶体结构(如图1),可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中,则NiO晶体中原子填充在氧原子形成的____体空隙中,其空隙的填充率为____。
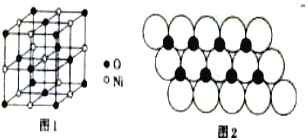
(5)一定温度下,NiO晶体可分散形成“单分子层”,O2-作单层密置排列,Ni2+填充O2-形成的正三角形空隙中(如图2),已知O2-的半径为αm,每平方米面积上分数的NiO的质量为___g。(用a、NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火山爆发产生的气体中含有少量的羰基硫(分子式是:COS),已知羰基硫分子结构与CO2类似,有关说法正确的是( )
A.羰基硫是电解质
B.羰基硫分子的电子式为:![]()
C.C、O、S三个原子中半径最小的是C
D.羰基硫分子为非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将水分解制得氢气的一种工业方法是“硫﹣碘循环法”,依次涉及下列三步反应:
I.SO2+2H2O+I2=H2SO4+2HI
II.2HI(g)H2(g)+I2(g)
III.2H2SO4=2SO2+O2+2H2O
(1)一定温度下,向5L恒容密闭容器中加入1molHI,发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=___。相同温度下,若起始加入的HI改为2mol,反应达平衡时H2的量为___mol。
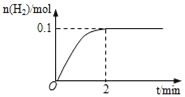
(2)分析上述反应,下列判断错误的是___(填写选项编号,只有一个正确选项)。
a.三步反应均为氧化还原反应
b.循环过程中产生1molH2,同时产生1molO2
c.在整个分解水的过程中SO2和I2相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol·L-1,试计算:(写出简单的计算过程)
2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol·L-1,试计算:(写出简单的计算过程)
(1)x的值为多少________
(2)B的转化率为多少________
(3)平衡时A的浓度为多少________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某一密闭且体积不变的容器内有可逆反应:A(g)+2B(g) ![]() 2C(g)。该反应进行到一定限度后达到了化学平衡,不能作为判断该化学平衡标志的是
2C(g)。该反应进行到一定限度后达到了化学平衡,不能作为判断该化学平衡标志的是
A.容器内气体A的物质的量不再随时间而改变
B.容器内气体C的浓度不再随时间而改变
C.单位时间内生成amol物质A,同时生成2amol物质B
D.单位时间内生成amol物质A,同时生成2amol物质C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是最简单的有机二元酸,具有较强的还原性,工业上主要用于生产药物以及提炼稀有金属。
工业上可由以下反应制取草酸(两步反应均为液相反应):
①4CO+4C4H9OH+O2![]() 2(COOC4H9)2+2H2O
2(COOC4H9)2+2H2O
②(COOC4H9)2+2H2O![]() H2C2O4+2C4H9OH-Q(Q>0)
H2C2O4+2C4H9OH-Q(Q>0)
(1)反应①选择13~15MPa的高压条件下进行,最主要的原因是为了___。若5min内水的质量增加了7.2g/L,则用水表示的反应速率为____。
(2)对于反应②,下列能够说明其已经达到平衡的是____。
a.平衡常数K保持不变 b.反应液的pH保持不变
c.丁醇的浓度保持不变 d.反应液的总质量保持不变
下列措施既能加快该反应速率,又有利于提高产率的是___。
a.合理升高反应温度 b.合理增大反应压强
c.增大水的用量 d.加入稀硫酸作为催化剂
(3)将物质的量浓度相同的草酸溶液与次氯酸钠溶液等体积混合,产生大量无色无味的气体,写出反应的化学方程式____。
(4)已知草酸氢钠溶液显酸性,下列措施能使草酸氢钠溶液中![]() 减小的是___。
减小的是___。
a.通入HCl气体 b.加入草酸晶体 c.通入NH3 d.加入草酸钾晶体
(5)已知:物质的量浓度相同的草酸溶液与亚硫酸钠溶液等体积混合,反应的化学方程式为:①H2C2O4+Na2SO3→NaHC2O4+NaHSO3;草酸溶液与过量的亚硫酸钠溶液混合,反应的化学方程式为:②H2C2O4+2Na2SO3→Na2C2O4+2NaHSO3;过量的草酸溶液与亚硫酸钠溶液混合,反应的化学方程式为:③2H2C2O4+Na2SO3→2NaHC2O4+H2O+SO2↑
根据以上信息判断草酸的两级电离常数(记为K1、K2)与亚硫酸的两级电离常数(记为K3、K4)由大到小的顺序____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A.CO全部转化为乙醇B.正反应和逆反应的化学反应速率均为0
C.CO和H2以1∶2的物质的量之比反应生成乙醇D.反应体系中乙醇的物质的量浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的装置如图所示:
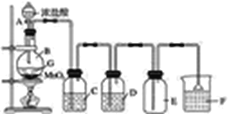
(1)实验原理:______________。
(2)实验装置:气体制备型化学实验装置的设计,要将化学反应原理、气体净化、收集和尾气处理等结合起来。
①填写装置中试剂名称,C______________,D____________,F__________。
②其中C的作用是除去氯气中的____________;D的作用是除去氯气中的____________。
③该装置中收集氯气使用的是________,还可用排__________的方法,原因是_____________。
④其中F的作用是_____________。
⑤检验氯气是否收集满可用__________放在集气瓶口,若试纸______,则证明已集满。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com