
| A. | 二氧化硫 | B. | 生石灰 | C. | 三氧化硫 | D. | 硫酸 |
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
 A图是物质M和N的溶解度曲线.B图中甲、乙试管分别盛 有M、N的饱和溶液,试管底均有未溶解的M、N固体.向烧杯中加入一种物质后,甲中的固体减少,乙中的固体增加,则加入的物质可能是C
A图是物质M和N的溶解度曲线.B图中甲、乙试管分别盛 有M、N的饱和溶液,试管底均有未溶解的M、N固体.向烧杯中加入一种物质后,甲中的固体减少,乙中的固体增加,则加入的物质可能是C 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国拥有丰富的海洋资源,海水制盐历史悠久,早在5000年前的仰韶文化时期,先人就利用海水煮盐.为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
我国拥有丰富的海洋资源,海水制盐历史悠久,早在5000年前的仰韶文化时期,先人就利用海水煮盐.为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):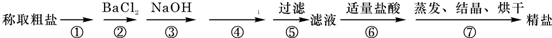
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷和丙烯 | B. | 乙烷和丙烯 | C. | 丙烯和丁炔 | D. | 丁烯和丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2LN2所含有的分子数为0.5NA | |
| B. | 在标准状况下,22.4 L CO和N2的混合物的物质的量为1mol | |
| C. | 在标准状况下,18g H2O的体积为22.4 L | |
| D. | 1mol SO2中原子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
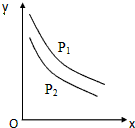 反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 增加L平衡右移 | ||
| C. | a>b | D. | a<b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com