
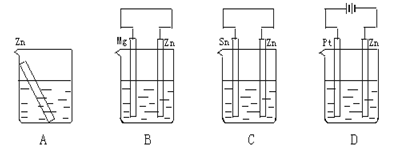
科目:高中化学 来源:不详 题型:单选题
| A | B | C | D |
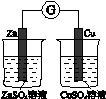 |  | 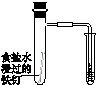 | 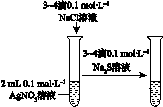 |
| 验证化学能 转化为电能 | 验证铅蓄电池 放电时Pb为负极 | 验证铁 发生析氢腐蚀 | 验证AgCl 溶解度小于Ag2S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
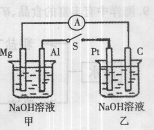
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
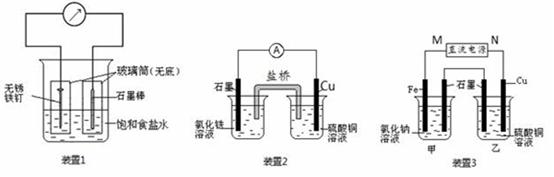
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
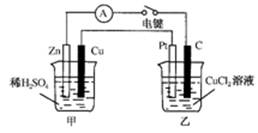
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.轮船水线以下的船壳上装一定数量的锌块 |
| B.铁可以在氯气中燃烧 |
| C.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| D.镀锌的铁比镀锡的铁耐用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一般来说,金属发生化学腐蚀的速率比电化学腐蚀速率要快 |
| B.保护地下钢管不受腐蚀,可使它连接直流电源的负极 |
| C.钢铁发生析氢腐蚀时,正极的电极反应式为:2H2O+O2+4e-=4OH- |
| D.轮船底部放一块锌块,所采用的防腐方法为牺牲阴极的阳极保护法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
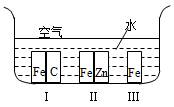
| A.在上图所示环境中,铁被腐蚀速率:Ⅰ>Ⅲ>Ⅱ |
| B.军事演习期间给坦克的履带上刷上油漆以防止生锈 |
| C.在海轮的外壳上常焊有锌块,且定期更新 |
| D.将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com