
����Ŀ��A�ǻ�ѧʵ������������л����������ˮ����������ζ���ܽ�����ͼ��ʾ�Ķ��ַ�Ӧ��

��1��д��D�Ĺ���������_____________________��
��2��д����Ӧ���Ļ�ѧ����ʽ____________________��
��3��������Ӧ��ʱ����____________________��������Һ����������Һ��ײ�������
��4��д����Ӧ���ķ�Ӧ����___________��
��5����B��һ��̼ԭ����B��ͬϵ������һ�������¿������ۺϷ�Ӧ������һ�������ӻ������д���÷��ɵĻ�ѧ����ʽ______________��
���𰸡���1��ȩ����
��2��CH3COOH+C2H5OH![]() CH3COOC2H5+H2O��
CH3COOC2H5+H2O��
��3��Һ��ײ�����4���ӳɷ�Ӧ��
��5��![]()
��������
���������A�ǻ�ѧʵ������������л����������ˮ����������ζ����A���Ҵ�����ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ�������B����ϩ���Ҵ���������Ũ�������ʱ���ڼ��������·���������Ӧ��������������ˮ�����C�������������Ҵ��ڼ���ʱ��Cu�����£���������������D����ȩ���Ҵ������Na������Ӧ����E���Ҵ��ơ���1�� D����ȩ��������������ȩ������2������Ӧ�����Ҵ������ᷢ��������Ӧ����Ӧ�Ļ�ѧ����ʽ��CH3COOH+C2H5OH![]() CH3COOC2H5+H2O����3��������Ӧ��ʱ�������Ҵ����ܶȱȽ���NaС����������Һ��ײ�����4����Ӧ������ϩ��ˮ�����ļӳɷ�Ӧ�����Է�Ӧ�����Ǽӳɷ�Ӧ����5����B��һ��̼ԭ�ӵ�B��ͬϵ���DZ�ϩCH2=CH-CH3����һ�������¿ɷ����ۺϷ�Ӧ������һ�ָ߷��ӻ�����÷��ɵĻ�ѧ����ʽ��
CH3COOC2H5+H2O����3��������Ӧ��ʱ�������Ҵ����ܶȱȽ���NaС����������Һ��ײ�����4����Ӧ������ϩ��ˮ�����ļӳɷ�Ӧ�����Է�Ӧ�����Ǽӳɷ�Ӧ����5����B��һ��̼ԭ�ӵ�B��ͬϵ���DZ�ϩCH2=CH-CH3����һ�������¿ɷ����ۺϷ�Ӧ������һ�ָ߷��ӻ�����÷��ɵĻ�ѧ����ʽ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��ǰ������ȡ����Ӧ���������ڼӳɷ�Ӧ���ǣ� ��
A. ���ռ����������Ļ�����ϩʹ���Ը��������Һ��ɫ
B. ![]() ����ϩ��ˮ������һ�����������Ҵ�
����ϩ��ˮ������һ�����������Ҵ�
C. ��ϩʹ������Ȼ�̼��Һ��ɫ ������������һ�������·�Ӧ���ɻ�����
D. �ڱ��е�����ˮ����ˮ��ɫ �� ��ϩʹ��ˮ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ƽ�� Zn �� HNO3����ϡ�� == Zn��NO3��2 �� NH4NO3 �� H2O
��2��д��ʵ������ȡNH3�Ļ�ѧ����ʽ�� ��
��3����ȥһ�������е�����������������÷������÷���ʽ��ʾ�� ��
��4���ں�Cu����ø���������Ļ���ģ��������������NO2������ת��ΪNO��д��Cu��������ˮ��Һ����NO2����Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ը��������Һ�м���������Ʒ�ĩ����Һ��ɫ�����з�����Ӧ�����ӷ���ʽΪ��2MnO![]() +16H++5Na2O2�T2Mn2++5O2��+8H2O+10Na+�������ж���ȷ�ģ� ��
+16H++5Na2O2�T2Mn2++5O2��+8H2O+10Na+�������ж���ȷ�ģ� ��
A��Na2O2���������������ǻ�ԭ��
B��O2�ǻ�ԭ���Mn2+����������
C��ͨ����Ũ�����ữ���������Һ
D����״���£�����22.4 L O2ʱ��Ӧת��2 mol e��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ[Mg(ClO3)2]����������������ݼ��ȣ�ʵ�����Ʊ���Mg(ClO3)2��6H2O���������£�

��֪����±����Ҫ�ɷ�ΪMgCl2��6H2O������MgSO4��FeCl2�����ʡ�
�����ֻ�������ܽ��(S)���¶�(T)�仯������ͼ��

��1����MgO�����������������Ҫ�ɷ�Ϊ _____��
��2������BaCl2��Ŀ���dz�ȥSO42������μ���SO42���ѳ�����ȫ�� ___��
��3������NaClO3������Һ�ᷢ�����·�Ӧ��MgCl2��2NaClO3![]() Mg(ClO3)2��2NaCl���������ø÷�Ӧ�������ͼ����ȡMg(ClO3)2��6H2O��ʵ�鲽������Ϊ�� ��ȡ��������NaClO3������Һ��ַ�Ӧ���������ᾧ���� ���� �������ˡ�ϴ�ӡ�
Mg(ClO3)2��2NaCl���������ø÷�Ӧ�������ͼ����ȡMg(ClO3)2��6H2O��ʵ�鲽������Ϊ�� ��ȡ��������NaClO3������Һ��ַ�Ӧ���������ᾧ���� ���� �������ˡ�ϴ�ӡ�
��4������Ʒ����ˮϴ�ӣ�������ˮ�Ҵ���ϴ����ˮ�Ҵ���������___________________��
��Ʒ��Mg(ClO3)2��6H2O������Է�������Ϊ299�������IJⶨ��
����1��ȷ����3.50g��Ʒ�ܽⶨ�ݳ�100mL��Һ��
����2��ȡ10mL����ƿ�У�����10mLϡ�����20mL1.000mol/L��FeSO4��Һ���ȡ�
����3����ȴ�����£���0.100mol/LK2Cr2O7��Һ�ζ����յ㡣�˹����з�Ӧ�����ӷ���ʽΪ��
Cr2O72����6Fe2����14H��![]() 2Cr3����6Fe3����7H2O��
2Cr3����6Fe3����7H2O��
����4��������2��3�ظ����Σ�ƽ������K2Cr2O7��Һ15.00mL��
��5��д������2�з��������ӷ���ʽ_______________________��
��6��������Ʒ�ⶨ����Ҫ����Ƿ�©Һ��������_____________________��
����3�����ζ�ǰ���ñ�Һ��ϴ�ζ��ܣ��ᵼ�����ս��ƫ___________��������������С������
��7����Ʒ��Mg(ClO3)2��6H2O����������Ϊ ______ ��(������������λС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú�������Ǹ�Ч����������ú̿����Ҫ;��֮һ��
��1����̿��ˮ������Ӧ�ǽ�����ú��Ϊ����ȼ�ϵķ�������֪��
�� C(s)+ O2 (g) = CO2 (g) ��H = -393.5 kJ��mol-1
�� CO(g) + ![]() O2 (g) = CO2 (g) ��H = -283.0 kJ��mol-1
O2 (g) = CO2 (g) ��H = -283.0 kJ��mol-1
�� H2(g) + ![]() O2 (g) = H2O (g) ��H = -241.8 kJ��mol-1
O2 (g) = H2O (g) ��H = -241.8 kJ��mol-1
��̼��ˮ������Ӧ����һ����̼���������Ȼ�ѧ����ʽ�� ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K���¶ȵ����߽� ������������������С����������������
��2��CO������H2O(g)��һ��������ӦCO(g) + H2O(g)![]() CO2(g)+H2(g) ��H��0���ڼס������������ܱ�����������ʼʱ�����±����ݽ���Ͷ������800��ʱ�ﵽƽ��״̬��K=1.0��
CO2(g)+H2(g) ��H��0���ڼס������������ܱ�����������ʼʱ�����±����ݽ���Ͷ������800��ʱ�ﵽƽ��״̬��K=1.0��
H2O | CO | CO2 | H2 | |
�� n/ mol | 0.10 | 0.30 | 0.10 | 0.50 |
�� n/ mol | 0.20 | 0.20 | 0 | 0 |
��ʼʱ���������з�Ӧ�� ����������Ӧ�������淴Ӧ����������У�ƽ��ʱ����������CO��ת����Ϊ ��

����ͼ��ʾ������Ӧ��t1ʱ�̴ﵽƽ�⣬��t2ʱ����ı�ij�������������仯���������t2ʱ�̷����ı�����п��ܵ������� ��
��3����COΪȼ������ȼ�ϵ�أ���ص�������O2��CO2������ͨ��CO�������������̼���ƣ�����ʱ������ӦʽΪ ����ʹ�øõ�ص������Al2O3��ȡ10.8g Al������������Ҫ���������Ϊ����״���£� L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ǽ���ֲ����������е���ȡ�����ʹ���˺�ɳ���Ͼ�TA98��TA100�����ձ䣬���п��������ã����й��ڸ������ص�������ȷ����( )
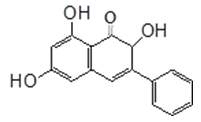
A���������صķ���ʽΪC15H15O5
B���������ط����к���3���ǻ���8��˫��
C��������������̼������Һ����ˮ�����Ը��������Һ�ȷ�Ӧ
D��1mol�����������������Ʒ�Ӧ����33.6LH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeBr2��FeI2�Ļ����Һ��ͨ��������������Һ��ijЩ���ӵ����ʵ����仯��ͼ��ʾ�������й�˵���в���ȷ���ǣ� ��
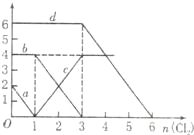
A��d���ߴ�����Һ��Br���仯���
B��ԭ��Һ��FeI2�����ʵ���Ϊ2mol
C��ԭ��Һ��n��Fe2+����n��Br����=2��3
D����ͨ��2mol Cl2ʱ����Һ�����ӷ�ӦΪ��2Fe2++2I��+2Cl2�T2Fe3++I2+4Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ��Ļ�ѧ���ʵ�����������ȷ���ǣ� ��
A. �ܷ���ȡ����Ӧ
B. ����ʹ���Ը��������Һ��ɫ
C. �ܷ����ӳɷ�Ӧʹ��ˮ��ɫ
D. ��ȼ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com