
| A. | 常温常压下,2.24LSO2所含有的分子数小于0.1NA | |
| B. | 1L 1 mol•L-1 FeCl3溶液完全水解产生的Fe(OH)3胶体粒子数为NA | |
| C. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| D. | 28.6gNa2CO3•10H2O溶于水配成1L溶液,该溶液中阴离子数目为0.1NA |
分析 A、常温常压下气体摩尔体积大于22.4L/mol;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、重水的摩尔质量为20g/mol;
D、碳酸根在溶液中水水解.
解答 解:A、常温常压下气体摩尔体积大于22.4L/mol,故2.24L二氧化硫的物质的量小于0.1mol,故分子个数小于0.1NA个,故A正确;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒的个数小于NA个,故B错误;
C、重水的摩尔质量为20g/mol,故18g重水的物质的量为0.9mol,故含9NA个质子,故C错误;
D、28.6gNa2CO3•10H2O的物质的量为0.1mol,而溶于水后碳酸根在溶液中水水解,导致阴离子个数增多,故溶液中的阴离子的个数多于0.1NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | O-O | O═O | O-H |
| 能量(kJ) | 436 | 138 | 498 | 465 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
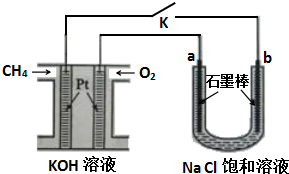
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 用途 | 解释 |
| A | H2O2 | 消毒剂 | H2O2具有强氧化性,可杀菌 |
| B | SiO2 | 计算机芯片 | SiO2是一种良好的半导体 |
| C | Fe3O4 | 红色涂料 | Fe3O4是一种红色氧化物 |
| D | 浓H2SO4 | 干燥剂 | 浓H2SO4有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液、胶体和浊液这三种分散系的根本区别是分散质粒子直径的大小 | |
| B. | 硅单质广泛用于光纤通讯 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
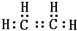 B的结构简式CH3CH2OH
B的结构简式CH3CH2OH查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com