
NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.1.0L 1.0mol·L -1的NaAlO2水溶液中含 有的氧原子数为2NA
有的氧原子数为2NA
B.常温常压下,23gNO2中所含的氧原子数为0.5NA
C.常温常压下,11.2LCl2与足量Fe反应,转移电子数为NA
D.1mol的羟基与1mol的氢氧根离子所含质子数均为9NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年新疆哈密二中高二上期中化学试卷(解析版) 题型:选择题
在一密闭容器中进行反应:X2(g)+Y2(g)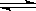 2Z(g),若X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡状态时,下列说法正确的是
2Z(g),若X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡状态时,下列说法正确的是
A.Z的浓度可能为0.3mol/L
B.平衡时X2、Y2的转化率相等
C.平衡时,Y2和Z的生成速率之比为2:1
D.若平衡后再改变外界条件,升高温度,则反应的平衡常数 将变大
将变大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高二期中化学卷(解析版) 题型:填空题
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知 :CO(g)+H2O(g)
:CO(g)+H2O(g) H2(g)+CO2(
H2(g)+CO2( g)的平衡常数随温度
g)的平衡常数随温度 的变化如下表:
的变化如下表:
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应平衡常数的表达式为 _____________,正反应是___________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率___________(填“增大”“减小”或“不变”),容器内混合气体的压强______________(填“增大”“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 ____________ (选填字母)。
A | B | C | D | |
n(CO2)/mol | 3[ | 1 | 0 | 1 |
n(H2)/mol | 2 | 1 | 0 | 1 |
n(CO)/mol | 1 | 2 | 3 | 0.5 |
n(H2O)/mol | 5[ | 2 | 3 | 2 |
(4)830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高二期中化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.油脂有油和脂肪之分,在分类上都属于酯类
B.油脂、蛋白质都是由C、H、O三种元素组成
C.糖类、油脂、蛋白质都是高分子化合物
D.糖类、油脂、蛋白质都能发生水解反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:填空题
高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+ 550 kJ/mol,它由两步反应组成:
i.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ/molii.SO3(g)分解。
(1)SO3(g)分解的热化学方程式为________________。
(2)工业上常用SO2制备Na2S2O3,向0.1 mol/L的Na2S2O3溶液中滴加稀硫酸的离子方程式为_________。
(3)反应ii的△S_______________0(填 “>”、 “<”、 “=”)。
(4)对反应ii,可用V2O5 作催化剂。已知:SO2+V2O5 SO3+V2O4 K1、1/2O2+V2O4
SO3+V2O4 K1、1/2O2+V2O4 V2O5 K2, 则在相同温度下,2SO3(g)
V2O5 K2, 则在相同温度下,2SO3(g) 2SO2(g)+O2(g)的平衡常数 K=______________(用K1、K2表示)。
2SO2(g)+O2(g)的平衡常数 K=______________(用K1、K2表示)。
(5) L(L1、L2),X可分别代表压强或温度,右图表示L一定时,反应ii中SO3(g)的平衡转化率随X的变化关系。
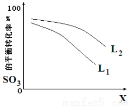
①X代表的物理量是_________________;
②比较L1、L2的大小_________________。
(6)维持体系总压p恒定,在T oC时,物质的量为9 mol、体积为2L的SO3(g)发生反应:2SO3(g) 2SO2(g)+O2(g), 已知SO3的平衡转化率25%,则在该温度下反应的平衡常数K=_____________(用最简分数表示)。
2SO2(g)+O2(g), 已知SO3的平衡转化率25%,则在该温度下反应的平衡常数K=_____________(用最简分数表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
苯甲酸钠(NaA)可作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2。已知25 ℃时,HA、H2CO3的电离平衡常数分别为 K=6.25×10-5、 K1=4.3×10-7,则下列说法正确的是(不考虑饮料中其他成分) ( )
A.提高CO2充气压力,饮料中c(A-)不变
B.当pH为5.0时,饮料中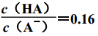
C.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
D.结合H+的能力:A-> HCO3-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上期中化学卷(解析版) 题型:简答题
《化学与生活》
(1)材料是人类赖以生存的物质基础
①制造水泥、玻璃都要用到的原料是___________(填字母)
A.石灰石 B.纯碱 C.黏土
②不锈钢丝与棉纤维可织成一种防辐射布料,这种布料属于___________(填字母)
A.合金材料 B.复合材料 C.陶瓷材料
③SiC是一种新型的陶瓷.工业上用石英砂与焦炭在高温条件下生成SiC,同时生成
CO,该制备反应的化学方程式为 。
(2)保证食品安全、合理使用药物是人体健康的基础。
①营养平衡、科学使用食品添加剂有助于健康和提高免疫力。下列物质常用作食品防腐剂的是________ (填字母)
A.苯甲酸纳 B.味精 C.柠檬黄
②下列药物厲于国际奥委会严格禁止的兴奋剂是_______(填字母)
A.阿司匹林 B.青霉素 C.吗啡
③氨基酸分子中含有的官能团是氨基和___________(写名称)。人体中共有20多种氨基酸,其中人体自身——(填“能”或“不能”)合成的氨基酸称为人体必须氨基酸.
④在一支盛有2 mL 2%淀粉溶液的试管中滴入2滴碘水,溶液呈_____________色,再滴入维生素C的水溶液,溶液颜色褪去,该实验说明维生素C具有________________(填“酸”、“氧化”、或“还原”)性。
(3)防治环境污染,改善生态环境己成为全球的共识。
①下列措施不利于改善环境质量的是_______________(填字母)
A.利用太阳能发电,以获取清洁能源
B.将废电池深埋土壤中,以减少污染
C.合成聚碳酸酯类可降解塑料代替聚乙烯
②向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成CaSO4。写出SO2转化为CaSO4的化学方程式________________________________________。
③天然水中含有的细小悬浮颗粒可以用明矾等作为混凝剂进行净化处理,该混凝剂的净水原理用离子方程式表示为_______________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:选择题
一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中 和O代表不同元素的原子。关于此反应说法错误的是
和O代表不同元素的原子。关于此反应说法错误的是
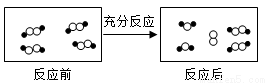
A.一定属于吸热反应 B.一定属于可逆反应
C.一定属于氧化还原反应 D.一定属于分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com