
| A. | 将少量氯化钴晶体溶于一定浓度的盐酸溶液呈紫色,加热后溶液颜色变成蓝色 | |
| B. | 中和热测定实验中,环形玻璃搅拌棒不能用铜质搅拌棒代替 | |
| C. | 容量瓶、分液漏斗、滴定管使用时都必须检查是否漏水 | |
| D. | 滴定管水洗后必须烘干才能使用 |
分析 A.将CoCl2溶于浓盐酸中能形成CoCl42-.溶液中存在如下平衡:CoCl42-(蓝色)+6H2O?Co(H2O)62+(粉红色)+4Cl-△H<0;
B.铜质仪器能传热;
C.含有活塞或塞子的仪器在使用前必须检漏;
D.滴定管水洗后不用烘干但必须用标准液润洗才能使用.
解答 解:A.由CoCl42-(蓝色)+6H2O?Co(H2O)62+(粉红色)+4Cl-△H<0可知,一般情况下,CoCl2溶液呈紫色,将盛有CoCl2溶液的试管放在热水中溶液逐渐变成蓝色,故A正确;
B.铜质仪器能传热导致测量不准确,所以中和热测定实验中,环形玻璃搅拌棒不能用铜质搅拌棒代替,故B正确;
C.含有活塞或塞子的仪器在使用前必须检漏,这几种仪器都含有塞子或活塞,所以容量瓶、分液漏斗、滴定管使用时都必须检查是否漏水,故C正确;
D.滴定管水洗后不用烘干但必须用标准液润洗才能使用,否则量取的溶液浓度变稀,故D错误;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器的选取、仪器使用、物质性质等知识点,明确实验原理、实验基本操作、仪器用途是解本题关键,注意实验操作的规范性,题目难度不大.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:实验题
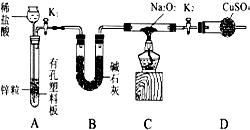
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、OH-、Na+、Cl- | B. | K+、NO3-、Cu2+、Cl- | ||
| C. | Ba2+、SO42-、Na+、OH- | D. | Fe3+、OH-、NH4+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经气化或液化这两个化学变化过程都可以转变为清洁能源 | |
| B. | 石油裂解目的是提高汽油的质量和产量 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 乙烯和苯均能发生氧化反应,说明两者都有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| B. | 用热的纯碱溶液清洗油污效果好 | |
| C. | 在H2、I2和HI组成的平衡体系加压后,混合气体颜色变深 | |
| D. | 常温下,将1 mL pH=3的醋酸溶液加水稀释至100 mL,测得其pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锡铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锌铁制品则相反 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡时氢气转化率增大 | |
| D. | 给0.1mol•L-1CH3COOH溶液中加热,则c(H+)与c(CH3COOH)的比值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
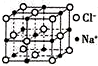 由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症.
由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症. ,未成对电子数为5.
,未成对电子数为5.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
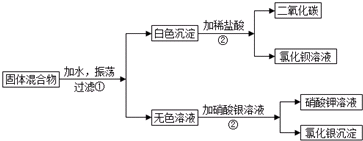
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
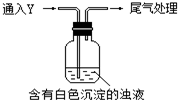 某校探究性活动小组的同学对Na2SO3与AgNO3在不同的pH条件下的反应原理进行实验探究,请你一起参与探究活动并回答有关问题:
某校探究性活动小组的同学对Na2SO3与AgNO3在不同的pH条件下的反应原理进行实验探究,请你一起参与探究活动并回答有关问题:| 实验 | pH | 实 验 现 象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com