
【题目】下列物质属于电解质的是( )
A.CuB.NaOH溶液C.NH3D.HCl
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下不能实现的是( )
A. 饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
B. MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO
C. Al2O3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
D. Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇可以发生下列化学反应。在反应里乙醇分子断裂C-O键而失去羟基的是( )
A. 乙醇与乙酸的酯化反应 B. 乙醇与金属钠反应
C. 乙醇在浓H2SO4存在下发生消去反应 D. 乙醇的催化氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
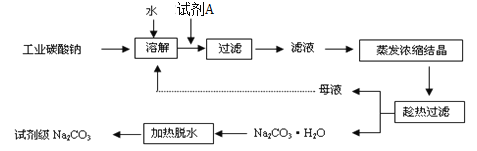
碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
![]()
请回答下列问题:
①试剂A是_______,“母液”中除了含有Na+、CO32-、OH-外,还含有_____等离子,过滤要“趁热”的目的是______。
②检验试剂Na2CO3中Cl-和SO42-是否除尽,选用的试剂及加入的先后次序是___________(填字母)。
a.HCl、BaCl2、AgNO3 b.AgNO3 HNO3、Ba(NO3)2 c. HNO3、Ba(NO3)2、AgNO3 d.AgNO3、HCl、BaCl2
(2)“侯氏制碱法”的原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
如图是某兴趣小组在实验室中模拟“侯氏制碱法”制取NaHCO3所用到的主要装置。

请回答下列问题:
①各仪器口的连接顺序为a接________接b,实验时先向饱和NaCl溶液中通入较多的NH3,再通人足量的CO2,其原因是________(填 写序号字母)。
a.使CO2更易被吸收 b.NH3比CO2更易制取 c.CO2的密度比NH3大
②将生成的NaHCO3晶体从混合物中分离出来需要的玻 璃仪器是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 标准状况下任何气体的摩尔体积都是 22.4 L
B. 1 mol 气体的体积若是 22.4 L,它必定处于标准状况
C. 两种气体的物质的量之比等于其原子个数比
D. 标准状况下,1 mol H2 和 O2 的混合气体的体积约是 22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】. 下列反应的离子方程式中,书写正确的是
A. 实验室用大理石跟稀盐酸制取二氧化碳:2H+ + CO32- = CO2↑+ H2O
B. 将铝粉投入氢氧化钠溶液中: 2Al + 2OH- = 2AlO2- + H2↑
C. 氯气溶于水:Cl2 + H2O= 2H+ + Cl- + ClO-
D. 金属钠与水反应:2Na + 2H2O = 2Na+ + 2OH-+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500 ℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和__________。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。

① A中固体充分加热较长时间后,通入氮气,目的是__________________________。
②为验证A中残留物是否含有FeO,需要选用的试剂有____________(填字母)。
A.KSCN溶液 B.稀硫酸
C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有________气体生成,若含有该气体,观察到的现象为_______________________________________。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为b mol,C中沉淀物质的量为a mol,则b________________(填“大于”“小于”或“等于”)a。
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为___________________________________________(用离子方程式表示)。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
测定原理:MnO![]() +Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
+Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
测定步骤:步骤一:准确称量20.00 g硫酸亚铁铵晶体,配制成100 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,用0.100 0 mol·L-1 KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00 mL。
①如何判断滴定终点?________________________;
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol·L-1NaOH溶液,所加NaOH 溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是( )
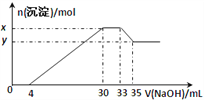
A. x-y=2×10-3mol
B. 原溶液中n(Cu2+)=0.025mol
C. 原溶液的pH=2
D. 原溶液中c(NH4+)=7.5×10-3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( ) 
A.该反应是吸热反应
B.断裂1molA﹣A键和1molB﹣B键可放出xkJ能量
C.断裂2molA﹣B键需要吸收ykJ能量
D.2molAB的总能量高于1molA2和1molB2的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com