
【题目】一定温度下,10mL0.40molL-1H2O2在MnO2作用下发生反应 :2H2O2 ( aq)=2H2O(l )+O2( g) △H <0, 不同时刻测定生成O2的物质的量如下表所示 :
t/min | 0 | 3 | 6 | 10 | ……. |
n(O2)/mol | 0.0 | 0.0008 | 0.001 | 0.0012 | ……. |
下列叙述不正确的是(溶液体积变化忽略不计)
A.升高温度,可加快H2O2 的分解速率
B.若增大溶液起始浓度,则收集到 0.0 008 mol O2 的时间会小于3 min
C.反应至 6min 时,溶液 中 c(H2O2)=0.2mol L-1
D.反应至 12min 时,H2O2分解率为 65%
【答案】D
【解析】
A.升高温度,反应速率加快,所以升高温度,可加快H2O2 的分解速率,A正确;
B.若增大溶液起始浓度,反应速率加快,则收集到 0.0008 mol O2 的时间会小于3 min,B正确;
C.反应至 6min 时,收集到0.001mol氧气,根据反应方程式,消耗的H2O2为0.002mol,所以溶液中 c(H2O2)=![]() = 0.2mol L-1,C正确;
= 0.2mol L-1,C正确;
D.反应至12min时,若H2O2分解率为65%,则生成氧气的物质的量为![]() = 0.0013mol。从第6min到10min,生成氧气的物质的量为0.0012-0.001=0.0002mol,而从第10min到第12min,生成氧气的物质的量为0.0013-0.0012=0.0001mol,即第6min到10min和第10min到第12min两个时间段的速率相等,但随着反应进行,H2O2浓度降低,反应速率应该减慢,所以反应至12min时,H2O2分解率应小于65%,D错误;
= 0.0013mol。从第6min到10min,生成氧气的物质的量为0.0012-0.001=0.0002mol,而从第10min到第12min,生成氧气的物质的量为0.0013-0.0012=0.0001mol,即第6min到10min和第10min到第12min两个时间段的速率相等,但随着反应进行,H2O2浓度降低,反应速率应该减慢,所以反应至12min时,H2O2分解率应小于65%,D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为______molL-1。
(2)某学生欲用上述浓盐酸和蒸馏水配480mL物质的量浓度为0.200molL-1的稀盐酸。
①配制稀盐酸时,应选用容量瓶的规格是_______mL。
②该学生需要用取___mL上述浓盐酸进行配制。
③若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”、“偏低”或“无影响”)
量取浓盐酸时俯视刻度线_____,定容时仰视刻度线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH相同、体积均为V0的两种酸溶液分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
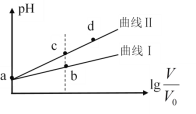
A.曲线Ⅰ代表CH3COOH溶液
B.溶液中水的电离程度:b点小于c点
C.相同体积a点的两种酸分别与NaOH溶液恰好中和后,溶液中n(NO2-)>n(CH3COO-)
D.由c点到d点,溶液中![]() 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,气体被还原的是
A.水蒸气使 CuSO4固体变蓝B.氯气使浅绿色 FeC12 溶液变黄
C.H2使灼热CuO 固体变红D.氨气使A1Cl3溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于葛根素(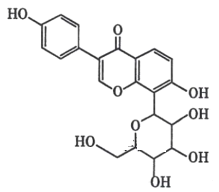 )的说法,正确的是
)的说法,正确的是
A.0.1 mol 葛根素完全燃烧,生成 22.4L(标准状况)H2O
B.1mol 葛根素与溴水反应,最多消耗 2.5mol Br2
C.一定条件下,葛根素能发生氧化、消去及水解等反应
D.与足量 H2 发生加成反应,该分子中官能团的种类减少 2 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制1.00mol/L的Na2CO3溶液100mL,造成所配溶液浓度偏高的原因是( )
A. 烧杯和玻璃棒没有洗涤
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 称量碳酸钠晶体(Na2CO310H2O)的烧杯未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙(如下图)三种晶体的晶胞(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶胞中x与y的个数比是__________,乙晶胞中a与b的个数比是__________,丙晶胞中有________个c离子,有________个d离子。
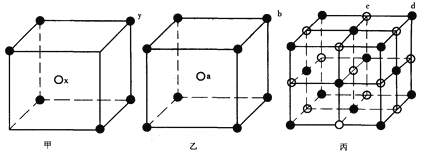
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按第26届国际计量大会重新定义,阿伏加德罗常数(NA)有了准确值6.02214076×1023。下列有关NA的说法正确的是( )
A.28g乙烯与丙烯的混合气体中含有4NA个C-H键
B.标准状况下,3.36LNO2中氧原子数目为0.3NA
C.1L1mol·L-1的CH3COOH溶液与1L0.5mol·L-1的NaOH溶液混合后,CH3COO-的数目为0.5NA
D.理论上,149gNaClO与足量KI溶液反应可得到NA个碘分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是
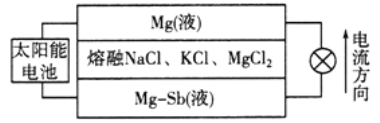
A. 放电时,Mg(液)层的质量减小
B. 放电时,正极反应为:Mg2++2e===Mg
C. 该电池充电时,Mg—Sb(液)层的质量增大
D. 该电池充电时,C1向下层方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com