
下列各组物质互为同系物的是( )
A.2H与3H B.CH(CH3)3与 CH3CH2CH2CH3
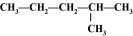 C.C2H6与C(CH3)4 D.O2与O3
C.C2H6与C(CH3)4 D.O2与O3
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016届黑龙江省高三考训练四理综化学试卷(解析版) 题型:选择题
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
下列有关说法正确的是 ( )
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表,水解方程式ClOˉ+ H2O HClO + OHˉ的水解常数K≈10ˉ7.6
HClO + OHˉ的水解常数K≈10ˉ7.6
D.向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F—)>c(H+)>c(HClO)>c(OH—)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二下期中理综化学试卷(解析版) 题型:选择题
煤是“工业的粮食”,石油是“工业的血液”。有关煤和石油加工的说法正确的是
A.煤的干馏产物主要是各类有机物
B.石油的裂解、分馏和煤的干馏都属于化学变化
C.煤焦油经过分馏可得到苯、甲苯等,说明煤中含有苯和甲苯
D石油的裂化,说明长链烃在高温条件下可以分解为短链烃
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下期中化学试卷(解析版) 题型:填空题
现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
T | 最外层电子数是电子层数的3倍 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是__________;X的一种氢化物燃烧时火焰温度高,可以焊接金属,则该氢化物的结构式为 ;实验室制取该气体的化学方程式是 。
(2)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol·L-1 NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为 g。
(3)元素Y与氢元素形成一种离子YH,写出该微粒的电子式____________(用元素符号表示)。实验室检验该微粒的方法是: 。
(4)T元素在周期表的位置: ,其简单阴离子的结构示意图: , 证明该粒子的还原性比Z— 强的离子方程式是 。硒(Se)是人体必需的微量元素,与T在同一主族,Se原子比T原子多一个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物的化学式为________。
(5)元素Z与氢氧化钠溶液反应的化学方程式为 ,其生成的含氧酸盐的电子式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下期中化学试卷(解析版) 题型:选择题
1mol气态烃CxHy,完全燃烧需要氧气5mol,则x与y的和可为( )
A.5 B.7 C.9 D.11
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下期中化学试卷(解析版) 题型:选择题
下列关于元素性质的有关叙述中正确的是
A.可以用HClO和H2SO3酸性的相对强弱来比较Cl和S的非金属性强弱
B.金属和非金属之间一定能形成离子化合物
C.碱金属元素单质,由Li→Fr,熔点逐渐降低
D.沸点:HI>HBr>HCl>HF
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下期中化学试卷(解析版) 题型:选择题
下列关于性质递变规律的叙述,不正确的是( )
A.还原性Na>Mg>Al B.氧化性Cl>S>P
C.酸性H2SO4>H3PO4>HClO4 D.稳定性HCl>H2S>PH3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期中化学试卷(解析版) 题型:选择题
分析化学中常用X射线研究晶体结构,有一种晶体可表示为[MxFey(CN)z],研究表明它的结构特性是Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,其晶体中的阴离子晶胞结构如图所示,下列说法正确的是( )
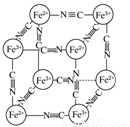
A.该晶体属于原子晶体
B.M的离子位于上述晶胞的面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价
D.晶体的化学式可表示为MFe2(CN)6,且M为+1价
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下第一次月考化学试卷(解析版) 题型:填空题
(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ;1 mol O22+中含有的π键数目为____________________。
(2)Fe2(SO4)3晶体中铁离子的核外电子排布式为 。
(3)乙醇与乙醛的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是 。
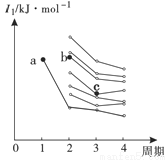
(4)右图是部分主族元素第一电离能梯度图,图中a点对应的元素为氢,b、c两点对应的元素分别为 、 (填元素符号)。
(5)亚硝酸的酸性强于次氯酸的原因为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com