
| A. | 在配制前用稀硫酸润洗容量瓶后,未用蒸馏水洗涤 | |
| B. | 定容摇匀后,发现液面低于刻度线,再加入蒸馏水至与刻度线相切 | |
| C. | 洗涤量筒,并将洗涤液转入容量瓶 | |
| D. | 定容时仰视读数. |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
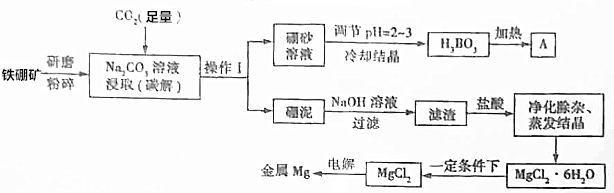
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b=100 | B. | a=b=1000 | C. | a<b | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
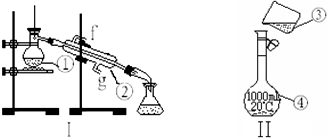
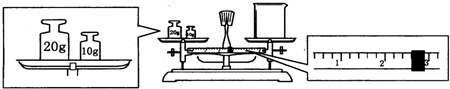
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
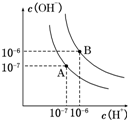 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol任何气体的体积都为22.4 L | |
| B. | 1 mol任何物质在标准状况下所占的体积都为22.4 L | |
| C. | 标准状况下,1 mol四氯化碳所占的体积是22.4 L | |
| D. | 标准状况下,22.4 L的任何气体的物质的量都是1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 湿法冶铜:Fe+CuSO4═FeSO4+Cu | |
| B. | 高炉炼铁:Fe2O3+3CO═2Fe+3CO2 | |
| C. | 制氧气:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | |
| D. | 制环氧乙烷:2C2H2( 乙炔)+O2$\frac{\underline{\;催化剂\;}}{加热}$2C2H4O ( 环氧乙烷) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com